题目内容
下列叙述正确的是( )
| A、常温常压下,17g羟基中所含电子数为9NA |
| B、常温下,1 molFe与足量浓硝酸反应,转移2 NA个电子 |
| C、常温常压下,22.4L的NO2和CO2混合气体含有2 NA个O 原子 |
| D、在0.1 mol过氧化钠中,阴离子总数等于0.2 NA |
考点:阿伏加德罗常数
专题:
分析:A、羟基中含有9个电子,17g羟基的物质的量为1mol,含有9mol电子;
B、常温下,铁与浓硫酸、浓硝酸发生钝化,阻止了反应继续进行;
C、常温常压下,不能使用标况下的气体摩尔体积计算22.4L混合气体的物质的量;
D、过氧化钠中含2个钠离子和1个过氧根离子;
B、常温下,铁与浓硫酸、浓硝酸发生钝化,阻止了反应继续进行;
C、常温常压下,不能使用标况下的气体摩尔体积计算22.4L混合气体的物质的量;
D、过氧化钠中含2个钠离子和1个过氧根离子;
解答:
解:A、17g羟基的物质的量为1mol,1mol羟基中含有9mol电子,所含电子数为9NA,故A正确;
B、在常温下,铁与浓硝酸发生钝化,阻止了反应继续进行,所以无法计算转移的电子数,故B错误;
C、不是标况下,题中条件无法计算22.4L混合气体的物质的量,故C错误;
D、过氧化钠中含2个钠离子和1个过氧根离子,故0.1mol过氧化钠中含0.1mol阴离子,故D错误.
故选A.
B、在常温下,铁与浓硝酸发生钝化,阻止了反应继续进行,所以无法计算转移的电子数,故B错误;
C、不是标况下,题中条件无法计算22.4L混合气体的物质的量,故C错误;
D、过氧化钠中含2个钠离子和1个过氧根离子,故0.1mol过氧化钠中含0.1mol阴离子,故D错误.
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
相关题目
已知NaHSO3溶液显酸性,溶液中存在以下平衡:HSO3-+H2O?H2SO3+OH-①HSO3-?H++SO32-②,向0.1mol?L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
| A、加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | ||||||||
B、加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+
| ||||||||
C、加入少量NaOH溶液,
| ||||||||
| D、加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-) |
氢原子的3d和4s能级的能量高低是( )
| A、3d>4s |
| B、3d<4s |
| C、3d=4s |
| D、无3d、4s轨道,无所谓能量高低 |
科学家预测原子序数为114的元素具有相当的稳定性,它的位置在第7周期ⅣA族,称为类铅,下列关于它的性质预测中,错误的是( )
| A、它的最外层电子数为4 |
| B、它的金属性比硅强 |
| C、它具有7个电子层 |
| D、它的最高价氧化物的水化物是强酸 |
将a g二氧化锰粉末加入b mol?L-1的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A、可以收集到氯气
| ||
| B、反应后溶液中的Cl-数目为2aNA/87 | ||
C、NA可表示为
| ||
| D、反应后溶液中的H+数目为(bc-2d) |
下列有关能量转化的说法中正确的是( )
| A、铝热反应属于吸热反应 | ||||
| B、“H-CI→H+C1“过程中放出热量 | ||||
| C、干冰升华过程放出热量 | ||||
D、 反应“C+H2O
|
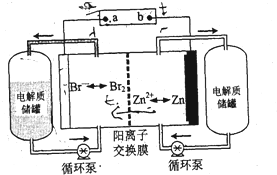 锌溴液流电池是一种新型电化学储能装置(如图所示)电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环,下列说法正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示)电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环,下列说法正确的是( )| A、充电时电极b连接电源的正极 |
| B、放电时正极的电极反应式为Zn-2e-=Zn2+ |
| C、阳离子交换膜可阻止Br2与Zn直接发生反应 |
| D、充电时左侧电解质储罐中的离子总浓度增大 |
