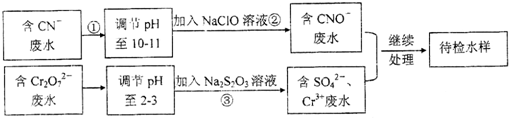
题目内容
12.环已醇(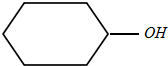 ),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃烧后,所得气体通过P2O5吸收瓶,瓶增重1.8g,则混合物的平均相对分子质量为( )
),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃烧后,所得气体通过P2O5吸收瓶,瓶增重1.8g,则混合物的平均相对分子质量为( )| A. | 68 | B. | 75 | C. | 80 | D. | 87.5 |
分析 环己醇、丙酮、乙醛的分子式分别为C6H12O、C3H6O、C2H4O,分子中C原子与H原子数目之比为1:2,则混合物中C原子与H原子数目之比为1:2,氧原子数目都相等为1,则平均分子组成为CnH2nO,气体通过P2O5吸收瓶,吸收瓶增重1.8g为生成水的质量,根据H元素守恒计算n的值,进而确定平均分子式,计算平均相对分子质量.
解答 解:环己醇、丙酮、乙醛的分子式分别为C6H12O、C3H6O、C2H4O,分子中C原子与H原子数目之比为1:2,则混合物中C原子与H原子数目之比为1:2,氧原子数目都相等为1,则平均分子组成为CnH2nO,气体通过P2O5吸收瓶,吸收瓶增重1.8g为生成水的质量,由化学式知1mol这个混合物燃烧生成x molH2O,
CnH2nO~~~nH2O
1.75g 1.8g
14n+16 18n
所以$\frac{1.75}{14n+16}=\frac{1.8}{18n}$
n=4.57,则
混合物的平均相对分子质量为14n+16=14×4.57+16=80,
故选C.
点评 本题有机物分子式确定、混合物的有关计算,难度中等,确定混合物中碳原子与氢原子数目之比为定比1:2是关键,注意利用平均组成进行解答.

练习册系列答案
相关题目
3.在理论上不能用于设计原电池的化学反应是( )
| A. | H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0 | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H<0 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H<0 | |
| D. | 3Cu(s)+8HNO3(aq)═3Cu(NO3)2(aq)+2NO(g)+4H2O(l)△H<0 |
20.二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如图:
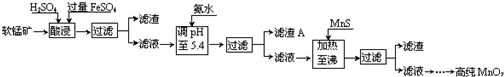
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
(1)FeSO4在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O.
(2)pH要调到5.4,应该使用pH计或精密pH试纸(填写仪器或试剂名称).滤渣A的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-=MnOOH+OH-.
(5)从废旧碱性锌锰电池中可以回收利用的物质有锌、二氧化锰(写两种).
(6)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=2.79×103.

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(2)pH要调到5.4,应该使用pH计或精密pH试纸(填写仪器或试剂名称).滤渣A的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-=MnOOH+OH-.
(5)从废旧碱性锌锰电池中可以回收利用的物质有锌、二氧化锰(写两种).
(6)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=2.79×103.
7.下列各组离子,能在溶液中大量共存的是( )
| A. | H+、Al3+、Cl-、NO3- | B. | Al3+、Mg2+、SO42-、OH- | ||
| C. | Fe2+、H+、K+、MnO4- | D. | Cu2+、H+、Cl-、HCO3- |
4.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 为了防止电池中的重金属等污染土壤和水体,应积极开发废电池回收利用技术 | |
| C. | 工业上采用电解熔融氯化铝制取金属铝 | |
| D. | 金属的腐蚀分为化学腐蚀和电化学腐蚀,但二者的本质相同 |
1.向下列液体中滴加稀硫酸,开始时生成沉淀,继续滴加稀H2SO4沉淀又溶解的是( )
| A. | Na2CO3溶液 | B. | BaCl2溶液 | C. | NaAlO2溶液 | D. | Fe(OH)3胶体 |
2.中草药秦皮中含有的七叶树内酯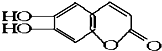 ,具有抗菌作用.若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为 ( )
,具有抗菌作用.若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为 ( )
 ,具有抗菌作用.若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为 ( )
,具有抗菌作用.若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为 ( )| A. | 3mol Br2;2mol NaOH | B. | 3mol Br2;4mol NaOH | ||
| C. | 2mol Br2;3mol NaOH | D. | 4mol Br2;4mol NaOH |
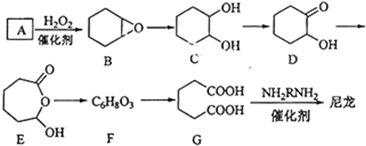
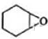 +H2O→
+H2O→ (不需注明条件,其他无机试剂任选).
(不需注明条件,其他无机试剂任选). .
.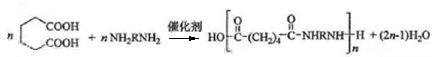 .
.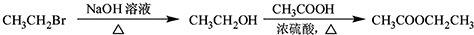
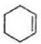 $\stackrel{溴的四氯化碳溶液}{→}$
$\stackrel{溴的四氯化碳溶液}{→}$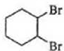 $→_{△}^{氢氧化钠/醇}$
$→_{△}^{氢氧化钠/醇}$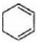 .
.