题目内容
15.下列转化不能通过一步反应实现的是( )| A. | CuO→Cu2O | B. | H2SiO3→SiO2 | C. | Cu→Cu2(OH)2CO3 | D. | Cu→Cu(OH)2 |
分析 A.氧化铜与氢气在加热条件下能够发生反应生成氧化亚铜;
B.H2SiO3加热分解生成SiO2;
C.Cu在空气中与氧气、二氧化碳和水蒸气可以一步反应得到Cu2(OH)2CO3;
D.Cu不可能通过一步反应得到氢氧化铜;
解答 解:A.氧化铜与氢气在加热条件下能够发生反应生成氧化亚铜,该反应可以通过一步反应实现,故A错误;
B.H2SiO3加热分解生成SiO2,该反应可以通过一步反应实现,故B错误;
C.Cu在空气中与氧气、二氧化碳和水蒸气可以一步反应得到Cu2(OH)2CO3,该反应可以通过一步反应实现,故C错误;
D.Cu不可能通过一步反应得到氢氧化铜,该反应不可以通过一步反应实现,故D正确;
故选D.
点评 本题考查了常见金属单质及其化合物性质,题目难度不大,明确常见金属单质及其化合物性质为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
3.下列电离方程式或水解方程式正确的是( )
| A. | H2S?2H++S2- | B. | NaHSO4═Na++H++SO42- | ||
| C. | CO32-+2H2O?H2CO3+2OH- | D. | Al3++3H2O?Al(OH)3↓+3H+ |
10.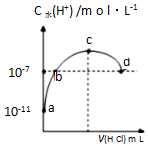 常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )
常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )
 常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )
常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )| A. | 常温下,0.1mol•L-1氨水的电离常数K约为1×10-5mol•L-1 | |
| B. | a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | c点溶液中c(NH4+)=c(Cl-) | |
| D. | d点代表两溶液恰好完全反应 |
20.我国科学家前不久成功合成3nm长的管状碳纳米管,长度居世界之首.这种碳纤维具有强度高、刚度(抵抗变形的能力)高、密度小(只有钢的$\frac{1}{4}$)、熔点高,化学稳定性好的特点,固此被称为“超级纤维”.下列对碳纤维的说法中不正确的是( )
| A. | 它是制造飞机的理想材料 | B. | 它的主要组成元素是碳元素 | ||
| C. | 它的结构与石墨相似 | D. | 碳纤维复合材料不易导电 |
7.氯碱工业是一种高能耗产业,下图表示的是电解池与燃料电池相组合的一种节能新工艺.图中电极末画出,只显示了相关物料的传输和转化关系.下列有关该工艺流程的分析正确的是( )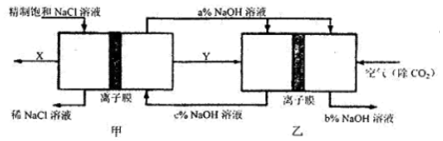

| A. | 甲装置为电解池,其左室为阴极室 | |
| B. | 甲乙两装置中使用的均为阳离子交换膜 | |
| C. | 乙装置为燃料电池,其左室反应为H2-2e-═2H+ | |
| D. | 图中三种NaOH溶液的质量分数关系为b%>c%>a% |
13.铁系氧化物材料在光催化、电致变色、气敏传感器以及光电化学器件中有着广泛的应用和诱人的前景.
实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160g固体铁红放出130kJ热量,则下列有关该反应的热化学方程式书写正确的是( )
实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160g固体铁红放出130kJ热量,则下列有关该反应的热化学方程式书写正确的是( )
| A. | 2FeCO3(s)+$\frac{1}{2}$O2 (g)=Fe2O3(s)+2CO2(g)△H=+130 KJ/mol | |
| B. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=+260 KJ/mol | |
| C. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol | |
| D. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol |