题目内容
2.由一氧化碳和二氧化碳组成的混合物18g,把它们完全燃烧后,测得二氧化碳的体积为11.2L(标准状况下),求原混合物中一氧化碳和二氧化碳各多少克?体积各多少升?分析 令CO和CO2的物质的量分别为xmol、ymol,根据二者质量及体积列方程计算并根据原子守恒结合V=$\frac{n}{c}$解答.
解答 解:令CO和CO2的物质的量分别为xmol、ymol,根据二者质量及体积,则:
$\left\{\begin{array}{l}{28x+44y=18}\\{x+y=\frac{11.2}{22.4}}\end{array}\right.$
解得x=0.25; y=0.25;
(1)原混合气体中,CO的质量是0.25mol×28g/mol=7g,CO2的质量为:18-7=11g,答:原混合物中一氧化碳和二氧化碳各是7g和11g;
(2)标况下,CO和CO2的体积是0.25mol×22.4L/mol=5.6L,答:体积各是5.6L.
点评 本题考查混合物计算,侧重对物质的量有关计算考查,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 某化合物的熔融状态能导电,该化合物中一定有离子键 | |
| B. | 冰是分子晶体,受热分解的过程中,只需克服分子间的作用力 | |
| C. | 某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键 | |
| D. | 化学变化中往往伴随着化学键的破坏与形成,物理变化中一定没有化学键的破坏或形成 |
13.下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是( )
①Na2SiO3 ②AlCl3 ③NH4HCO3 ④Al2O3 ⑤NaHCO3⑥Al ⑦Al(OH)3.
①Na2SiO3 ②AlCl3 ③NH4HCO3 ④Al2O3 ⑤NaHCO3⑥Al ⑦Al(OH)3.
| A. | ①②④ | B. | ②③⑤⑦ | C. | ②③⑥ | D. | ③④⑤⑥⑦ |
10.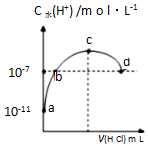 常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )
常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )
 常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )
常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )| A. | 常温下,0.1mol•L-1氨水的电离常数K约为1×10-5mol•L-1 | |
| B. | a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | c点溶液中c(NH4+)=c(Cl-) | |
| D. | d点代表两溶液恰好完全反应 |
17.现有14g乙烯和丙烯的混合气体.下列有关说法正确的是( )
| A. | 标准状况下混合气体的体积为22.4L | |
| B. | 完全燃烧生成44g CO2 | |
| C. | 混合气体中氢原子个数为2NA | |
| D. | 完全燃烧转移的电子数为3mol |
7.氯碱工业是一种高能耗产业,下图表示的是电解池与燃料电池相组合的一种节能新工艺.图中电极末画出,只显示了相关物料的传输和转化关系.下列有关该工艺流程的分析正确的是( )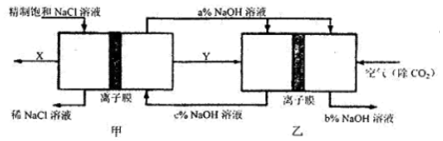

| A. | 甲装置为电解池,其左室为阴极室 | |
| B. | 甲乙两装置中使用的均为阳离子交换膜 | |
| C. | 乙装置为燃料电池,其左室反应为H2-2e-═2H+ | |
| D. | 图中三种NaOH溶液的质量分数关系为b%>c%>a% |
2.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 焰火的五彩缤纷是某些金属元素化学性质的表现 | |
| B. | 工业上以氯气和石灰乳为原料制备漂白粉 | |
| C. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆的原理相似 | |
| D. | 明矾作为净水剂,可以除去废水中的铜离子 |
20.22gNaHCO3和NaOH的混合物在密闭容器中加热到500℃使其充分反应后排出气体,然后冷却至常温,称得其质量变为20.2g,则下列说法正确的是( )
| A. | 反应后剩余固体为碳酸钠 | B. | 排出气体为CO2和水蒸气 | ||
| C. | NaOH的质量为13.6g | D. | NaHCO3的质量为18g |