题目内容
1.下列变化中,不可能通过一步反应实现的是( )| A. | SiO2→Na2SiO3 | B. | SiO 2→H 2SiO 3 | C. | CuSO 4→CuCl 2 | D. | Cu(OH)2→CuO |
分析 A.二氧化硅为酸性氧化物,与碱反应;
B.二氧化硅不溶于水;
C.硫酸铜与氯化钡可发生复分解反应;
D.氢氧化铜不稳定,加热易分解.
解答 解:A.SiO2$\stackrel{NaOH}{→}$Na2SiO3可一步反应实现,故A不选;
B.二氧化硅不溶于水,不能一步转化生成硅酸,故B选;
C.CuSO4$\stackrel{BaCl_{2}}{→}$CuCl2可一步反应实现,故C不选;
D.Cu(OH)2$\stackrel{△}{→}$CuO可一步反应实现,故D不选;
故选B.
点评 本题考查物质的性质及相互转化,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案
相关题目
11.200mL某硫酸盐溶液中,含硫酸根离子1.5NA个,含金属离子NA个,则该硫酸盐溶液的物质的量浓度为( )
| A. | 2.5mol/L | B. | 5mol/L | C. | 7.5mol/L | D. | 2mol/L |
12.下列说法正确的是( )
| A. | 某化合物的熔融状态能导电,该化合物中一定有离子键 | |
| B. | 冰是分子晶体,受热分解的过程中,只需克服分子间的作用力 | |
| C. | 某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键 | |
| D. | 化学变化中往往伴随着化学键的破坏与形成,物理变化中一定没有化学键的破坏或形成 |
9.下列化学用语正确的是( )
| A. | NaHCO3的水解:HCO3-+H2O?H3O++CO32- | |
| B. | 醋酸铵的电离:CH3COONH4?CH3COO-+NH4+ | |
| C. | 汽车尾气净化反应2NO+2CO=2CO2+N2能够自发进行,则该反应的△H>0 | |
| D. | 碳在高温下还原二氧化硅SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |
16.Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于表:
回答下列问题:
(1)Fe元素价电子层的电子排布式为3d64s2,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态).
(2)Fe原子或离子外围有较多能量相近的空轨道,能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是具有孤对电子.
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为分子晶体.
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为2:1,其中体心立方晶胞空间利用率为68%.
| 元素 | Mn | Fe | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)Fe元素价电子层的电子排布式为3d64s2,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态).
(2)Fe原子或离子外围有较多能量相近的空轨道,能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是具有孤对电子.
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为分子晶体.
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为2:1,其中体心立方晶胞空间利用率为68%.
13.下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是( )
①Na2SiO3 ②AlCl3 ③NH4HCO3 ④Al2O3 ⑤NaHCO3⑥Al ⑦Al(OH)3.
①Na2SiO3 ②AlCl3 ③NH4HCO3 ④Al2O3 ⑤NaHCO3⑥Al ⑦Al(OH)3.
| A. | ①②④ | B. | ②③⑤⑦ | C. | ②③⑥ | D. | ③④⑤⑥⑦ |
10.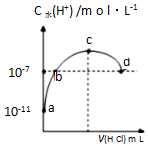 常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )
常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )
 常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )
常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )| A. | 常温下,0.1mol•L-1氨水的电离常数K约为1×10-5mol•L-1 | |
| B. | a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | c点溶液中c(NH4+)=c(Cl-) | |
| D. | d点代表两溶液恰好完全反应 |