题目内容
【题目】氢硫酸中存在电离平衡:H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
A. 加水,会使平衡向右移动,溶液中氢离子浓度增大
B. 加入20ml浓度为0.1mol/L NaOH溶液,则c(Na+)=c(HS-)+c(H2S)+2c(S2-)
C. 通入过量SO2气体,平衡向左移动,溶液pH值始终增大
D. 加入10ml浓度为0.1mol/L NaOH溶液,则c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)
【答案】D
【解析】A.加水稀释促进硫化氢电离,但氢离子浓度减小,选项A错误;B. 加入20ml浓度为0.1mol/L NaOH溶液,得到硫化钠溶液,根据物料守恒有c(Na+)=2c(HS-)+2c(H2S)+2c(S2-),选项B错误;C、通入过量SO2气体,二氧化硫与硫化氢反应生成硫和水,平衡向左移动,开始时溶液pH值增大,后当二氧化硫过量时生成亚硫酸则pH值减小,选项C错误;D、加入10ml浓度为0.1mol/L NaOH溶液,NaHS溶液,溶液呈碱性,则HS-水解大于电离,离子浓度大小为c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-),选项D正确。答案选D。

【题目】下列实验操作、现象与结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
B | 用乙醇与浓硫酸反应制乙烯,将产生的气体直接通入酸性高锰酸钾溶液中 | 高锰酸钾溶液的紫红色褪去 | 乙烯能被酸性高锰酸钾氧化 |
C | 向装有X溶液的试管中滴入浓NaOH溶液,将干燥的红色石蕊试纸置于试管口 | 无明显现象 | X溶液中无NH4+ |
D | 常温下,向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者 红色更深 | 结合质子的能力:CO32- > HCO3- |
A. A B. B C. C D. D
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。[已知N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4 kJ·mol-1]
2NH3(g)ΔH=-92.4 kJ·mol-1]
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是( )
A. 2c1>c3 B. α1+α3=1 C. 2 p2 <p3 D. a+b=92.4
【题目】S2Cl2用作橡胶的低温硫化剂和粘结剂,由硫与限量氯气在50~60℃反应制得,进一步氯化可得SCl2、S2Cl2、SCl2的某些性质如下:
水溶性 | 密度(g/cm3) | 颜色 | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,通水即分解 | 1.687 | 金黄色 | -76℃ | 138℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | 樱桃红 | -122℃ | 59℃ |
用如图所示装置制备S2Cl2回答下列问题:
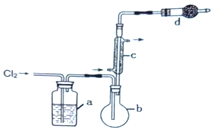
(1)写出S2Cl2的电子式_________。
(2)写出仪器c的名称_________;实验开始前先在b中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一固体薄层,这样做的目的是_________。
(3)实验时,b装置需加热。最好采用何种方式加热_________。
(4)b中的反应开始前,需排除装置中的空气,简述相关操作:_________。
(5)装置d中盛放的试剂是_________;其作用是①_________②_________。
(6)为了获得更纯净的S2Cl2,需要对产品进行的操作是_________。
(7)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的方程式_________。