题目内容
【题目】S2Cl2用作橡胶的低温硫化剂和粘结剂,由硫与限量氯气在50~60℃反应制得,进一步氯化可得SCl2、S2Cl2、SCl2的某些性质如下:
水溶性 | 密度(g/cm3) | 颜色 | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,通水即分解 | 1.687 | 金黄色 | -76℃ | 138℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | 樱桃红 | -122℃ | 59℃ |
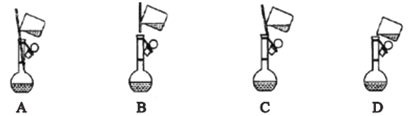
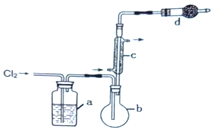
用如图所示装置制备S2Cl2回答下列问题:
(1)写出S2Cl2的电子式_________。
(2)写出仪器c的名称_________;实验开始前先在b中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一固体薄层,这样做的目的是_________。
(3)实验时,b装置需加热。最好采用何种方式加热_________。
(4)b中的反应开始前,需排除装置中的空气,简述相关操作:_________。
(5)装置d中盛放的试剂是_________;其作用是①_________②_________。
(6)为了获得更纯净的S2Cl2,需要对产品进行的操作是_________。
(7)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的方程式_________。
【答案】 ![]() 直型冷凝管 增大反应接触面积 水浴加热 通Cl2一段时间后,看到黄绿色气体充满装置b后,再开始加热b 碱石灰 防止空气中的水蒸气进入d使产品与水反应 吸收剩余的Cl2 分馏(或蒸馏) 2S2Cl2+2H2O=SO2↑+3S↓+4HCl
直型冷凝管 增大反应接触面积 水浴加热 通Cl2一段时间后,看到黄绿色气体充满装置b后,再开始加热b 碱石灰 防止空气中的水蒸气进入d使产品与水反应 吸收剩余的Cl2 分馏(或蒸馏) 2S2Cl2+2H2O=SO2↑+3S↓+4HCl
【解析】根据氯原子成一键,硫原子成二键规律,该物质的电子式为![]() ;正确答案:
;正确答案:![]() ;起到冷凝作用的应该用球型冷凝管;正确答案:球型冷凝管;为了加快反应速度,硫形成薄层附着在烧瓶内壁,增大接触面积;正确答案:增大反应接触面积;
;起到冷凝作用的应该用球型冷凝管;正确答案:球型冷凝管;为了加快反应速度,硫形成薄层附着在烧瓶内壁,增大接触面积;正确答案:增大反应接触面积;
(3)硫与限量氯气在50~60℃反应制得,所以可以用水浴加热;正确答案:水浴加热;
(4)先通入Cl2一段时间后,看到黄绿色气体充满装置b后,排净了装置内的空气。再开始加热b ;正确答案:通Cl2一段时间后,看到黄绿色气体充满装置b后,再开始加热b;
(5)装置d中盛放的试剂是碱石灰,它既可以吸收反应剩余的氯气,同时防止外界中水蒸气进入b装置,因为S2Cl2在空气中发烟雾,通水即分解;正确答案:碱石灰 ;防止空气中的水蒸气进入d使产品与水反应;
(6)制得的S2Cl2中含有SCl2等杂质,二者沸点差别较大,可以采用蒸馏的方法进行分离,以获得更纯净的S2Cl2;正确答案:分馏(或蒸馏);
(7)若将S2Cl2放入水中同时产生单质硫沉淀和氯化氢气体;根据电子得失守恒规律,还会有另外一种气体二氧化硫生成;正确答案: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl;