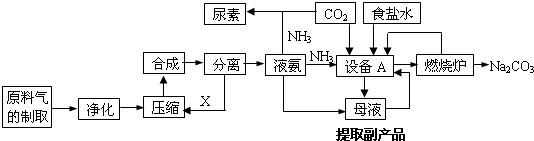
题目内容
16.运用化学反应原理分析解答以下问题.(1)已知:①CO(g)+2H2(g)?CH3OH(g)△H1=-91kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1
且三个反应的平衡常数依次为K1、K2、K3,则反应 3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247kJ•mol-1,化学平衡常数K=K=K12•K2•K3(用含K1、K2、K3的代数式表示).
(2)一定条件下,若将体积比为1:2的CO和.H2气体通入体积一定的密闭容器中发生反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),下列能说明反应达到平衡状态的是ac.
a.体系压强保持不变 b.混合气体密度保持不变
c.CO和H2的物质的量保持不变 d.CO的消耗速率等于CO2的生成速率
(3)氨气溶于水得到氨水.在25℃下,将x mol•L-1的氨水与y mol•L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)=c(Cl-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数$\frac{1{0}^{-7}y}{x-y}$.
(4)科学家发明了将NH3直接用于燃料电池的方法,其装置用铂作电极,插入电解质溶液中,一个电极通入空气,另一电极通入NH3.其电池反应式为:4NH3+3O2═2N2+6H2O,电解质溶液应显碱性(填“酸性”、“中性”或“碱性”),写出正极的电极反应方程式O2+2H2O+4e-=4OH-.
分析 (1)利用盖斯定律,抵消中间产物,得到目的反应,计算△H;平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;方程式相加时,总平衡常数等于分方程的平衡常数之积;
(2)反应到达平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化;
(3)根据电荷守恒,判断离子浓度大小;氨水的电离平衡常数为电离出离子的浓度积与溶质浓度的比值;
(4)NH3不能与电解质反应及正极得到电子化合价升高.
解答 解:(1)利用盖斯定律,反应①×2+反应②+反应③,得到目的反应,△H=-91kJ•mol-1
+(-24kJ•mol-1)+(-41kJ•mol-1)=-247kJ•mol-1,
反应①×2+反应②+反应③相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K12•K2•K3,
故答案为:-247kJ•mol-1; K=K12•K2•K3;
(2)a、反应前后气体体积不同,当压强一定时,达到化学平衡状态,故a正确;
b、体系体积一定,反应前后气体质量相同,密度始终不变,不能判断是否平衡,故b错误;
c、CO和H2的物质的量保持不变,则其他各物质浓度亦保持不变,达到化学平衡状态,故c正确;
d、CO的消耗速率等于CO2的生成速率,均为正反应方向,不能判断是否平衡,故d错误;
故选ac;
(3)写出电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),溶液呈中性,即c(H+)=c(OH-),即c(NH4+)=c(Cl-);氨水中的电离常数为$\frac{c(N{{H}_{4}}^{+}).c({H}^{+})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{y.1{0}^{-7}}{x-y}$=$\frac{1{0}^{-7}y}{x-y}$,故答案为:=;
$\frac{1{0}^{-7}y}{x-y}$;
(4)因NH3能与水反应,所以溶液呈碱性,因正极得到电子化合价升高,所以电极反应为:O2+2H2O+4e-=4OH-,故答案为:碱性;O2+2H2O+4e-=4OH-.
点评 本题考查弱电解质的电离、电化学原理、盖斯定律等知识点,侧重考查学生运用化学原理解答问题能力,易错点是化学平衡状态判断,只有反应前后改变的物理量才能作为化学平衡状态判断依据.

 习题精选系列答案
习题精选系列答案| A. | 将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的pH变大 | |
| B. | 盐酸和醋酸都可用相应的钠盐与浓度硫酸反应制取 | |
| C. | 相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大 | |
| D. | 相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
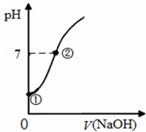 常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在次氯酸的电离平衡 | |
| B. | ②点所示溶液中:c(Na+)═c(Cl-)+c(ClO-) | |
| C. | I-能在②所示溶液中存在 | |
| D. | ①到②水的电离程度逐渐减小 |
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H2SO4 | D. | 热稳定性H2O>H2Se>H2S |
①KMnO4(H+,aq) ②品红溶液③溴水④氯水⑤Fe3+(aq)
| A. | ①③⑤ | B. | ①②③④ | C. | ①③④⑤ | D. | 只有② |
| 元素代号 | 原子半径/nm | 主要化合价 |
| X | 0.160 | +2 |
| Y | 0.143 | +3 |
| Z | 0.102 | +6、-2 |
| L | 0.099 | +7、-1 |
| M | 0.077 | +4、-4 |
| Q | 0.074 | -2 |
| A. | Z的氢化物的稳定性强于L的氢化物的稳定性 | |
| B. | Y与Q形成的化合物不能跟氢氧化钠溶液反应 | |
| C. | 等物质的量的X、Y的单质与足量的盐酸反应,生成的H2一样多 | |
| D. | 在化学反应中,M原子与其他原子易形成共价键而不易形成离子键 |
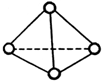 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )| A. | 1molN4气体转化为N2时要吸收206kJ能量 | |
| B. | N4是一种新型化合物 | |
| C. | 1molN4气体转化为N2时要放出740kJ能量 | |
| D. | N4是N2的同位素 |
| A. | 钡 | B. | 铅 | C. | 碘 | D. | 铁 |