题目内容
6.在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是( )| A. | 将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的pH变大 | |
| B. | 盐酸和醋酸都可用相应的钠盐与浓度硫酸反应制取 | |
| C. | 相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大 | |
| D. | 相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
分析 A.CH3COOH是弱酸,加水稀释促进CH3COOH电离;
B.较强的酸能和弱酸盐反应生成弱酸;
C.向酸中加入相应的钠盐固体,如果是弱酸,则抑制弱酸电离;
D.反应速率与离子浓度成正比.
解答 解:A.CH3COOH是弱电解质,加水稀释,电离程度增大,将等体积pH=4的HCl和CH3COOH稀释到pH=5的溶液,CH3COOH所加的水量应该多,且不能说明HCl完全电离,所以不能证明盐酸是强酸,故A错误;
B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取,说明硫酸酸性大于CH3COOH,浓硫酸制备HCl,是利用难挥发性酸制备易挥发性酸,不能证明盐酸是强酸,故B错误;
C.等体积、相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,CH3COOHpH变大,说明醋酸钠抑制CH3COOH电离,则证明CH3COOH是弱酸;加入氯化钠固体后,溶液pH不变,说明HCl完全电离,氯离子不影响HCl电离,所以能证明盐酸是强酸,故C正确;
D.反应速率与离子浓度成正比,开始时氢离子浓度相等,所以反应速率相等,不能说明HCl完全电离、CH3COOH部分电离,所以不能说明盐酸是强酸、CH3COOH是弱酸,故D错误;
故选C.
点评 本题考查了电解质强弱判断,明确强弱电解质的区别“电离程度”即可解答,注意D中反应速率只与氢离子浓度有关,与电解质强弱无关,为易错点.

练习册系列答案
相关题目
 ,0.5 mol任何气体的体积都约为11.2 L
,0.5 mol任何气体的体积都约为11.2 L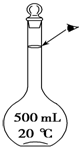 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤: 按要求完成下列各小题
按要求完成下列各小题