题目内容
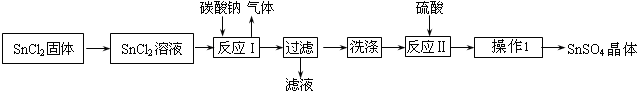
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业.某研究小组设计SnSO4制备路线如下:
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式.
Ⅱ.Sn2+的性质与Fe2+的性质相似.
回答下列问题:
(1)锡元素在周期表中的位置是 .
(2)用SnCl2固体配制SnCl2溶液的方法是 .
(3)反应I得到沉淀是SnO,该反应的离子方程式是 .
(4)洗涤SnO沉淀的方法是 .
(5)操作I是 .
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 .
(7)该小组通过下列方法测定所用SnCl2固体的纯度(杂质不参与反应):
①取6.00g SnCl2固体配制成100mL 溶液.
②取25.00mL溶液,向溶液中加入过量的FeCl3固体;
③再用0.10mol/L的K2Cr2O7标准溶液进行滴定,达终点时记录消耗K2Cr2O7标准溶液的体积.
④重复进行②、③两步操作,测定消耗K2Cr2O7标准溶液的平均体积为25.00mL.
试计算SnCl2固体的纯度(写出计算过程).

查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式.
Ⅱ.Sn2+的性质与Fe2+的性质相似.
回答下列问题:
(1)锡元素在周期表中的位置是
(2)用SnCl2固体配制SnCl2溶液的方法是
(3)反应I得到沉淀是SnO,该反应的离子方程式是
(4)洗涤SnO沉淀的方法是
(5)操作I是
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是
(7)该小组通过下列方法测定所用SnCl2固体的纯度(杂质不参与反应):
①取6.00g SnCl2固体配制成100mL 溶液.
②取25.00mL溶液,向溶液中加入过量的FeCl3固体;
③再用0.10mol/L的K2Cr2O7标准溶液进行滴定,达终点时记录消耗K2Cr2O7标准溶液的体积.
④重复进行②、③两步操作,测定消耗K2Cr2O7标准溶液的平均体积为25.00mL.
试计算SnCl2固体的纯度(写出计算过程).
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:SnCl2溶解得到溶液加入碳酸钠沉淀锡离子,过滤得到沉淀洗涤后加入硫酸溶解得到硫酸锡溶液,蒸发浓缩冷却结晶,过滤洗涤得到硫酸锡晶体;
(1)锡原子的核电荷数为50,与碳元素属于同一主族,处于ⅣA族,根据原子序数减各周期容纳元素种数确定所在的周期;
(2)由信息可知,SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(3)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳;
(4)洗涤沉淀在过滤装置中进行;
(5)操作Ⅰ是溶液中得到晶体的实验操作,蒸发浓缩,冷却结晶,过滤洗涤;
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水;
(7)根据电子转移守恒与方程式可得关系式Sn2+~2Fe3+~2Fe2+~
K2Cr2O7,据此计算.
(1)锡原子的核电荷数为50,与碳元素属于同一主族,处于ⅣA族,根据原子序数减各周期容纳元素种数确定所在的周期;
(2)由信息可知,SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(3)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳;
(4)洗涤沉淀在过滤装置中进行;
(5)操作Ⅰ是溶液中得到晶体的实验操作,蒸发浓缩,冷却结晶,过滤洗涤;
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水;
(7)根据电子转移守恒与方程式可得关系式Sn2+~2Fe3+~2Fe2+~
| 1 |
| 3 |
解答:
解:(1)锡元素与碳元素属于同一主族,处于ⅣA族,原子核电荷数为50,则:50-2-8-8-18=14,故Sn处于第五周期,则在周期表中的位置为第五周期第ⅣA族,
故答案为:第五周期第ⅣA族;
(2)由信息可知,SnCl2水解,发生SnCl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化,用SnCl2固体配制SnCl2溶液的方法是:将SnCl2固体溶于浓盐酸,加水稀释至所需浓度,再加入适量Sn粉;
故答案为:将SnCl2固体溶于浓盐酸,加水稀释至所需浓度,再加入适量Sn粉;
(3)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑,故答案为:Sn2++CO32-═SnO↓+CO2↑;
(4)洗涤SnO沉淀的方法是利用过滤装置进行洗涤,向过滤器中加入蒸馏水至浸没沉淀,待水完全流出后重复操作2-3次,故答案为:向过滤器中加入蒸馏水至浸没沉淀,待水完全流出后重复操作2-3次;
(5)操作Ⅰ是溶液中得到晶体的实验操作,蒸发浓缩,冷却结晶,过滤洗涤,
故答案为:加热浓缩、冷却结晶、过滤、洗涤;
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O;
故答案为:Sn2++H2O2+2H+═Sn4++2H2O;
(7)由实验过程可知,发生的反应为:2Fe3++Sn2+=Sn4++2Fe2+,6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,则:
Sn2+~2Fe3+~2Fe2+~
K2Cr2O7计算
1
n 0.0250L×0.100mol/L
解得n=0.0075mol,
100ml溶液中含有SnCl2 物质的量=0.0075mol×
=0.03mol;
SnCl2固体的纯度=
×100%=95.00%;
答:SnCl2固体的纯度为95.00%.
故答案为:第五周期第ⅣA族;
(2)由信息可知,SnCl2水解,发生SnCl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化,用SnCl2固体配制SnCl2溶液的方法是:将SnCl2固体溶于浓盐酸,加水稀释至所需浓度,再加入适量Sn粉;
故答案为:将SnCl2固体溶于浓盐酸,加水稀释至所需浓度,再加入适量Sn粉;
(3)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑,故答案为:Sn2++CO32-═SnO↓+CO2↑;
(4)洗涤SnO沉淀的方法是利用过滤装置进行洗涤,向过滤器中加入蒸馏水至浸没沉淀,待水完全流出后重复操作2-3次,故答案为:向过滤器中加入蒸馏水至浸没沉淀,待水完全流出后重复操作2-3次;
(5)操作Ⅰ是溶液中得到晶体的实验操作,蒸发浓缩,冷却结晶,过滤洗涤,
故答案为:加热浓缩、冷却结晶、过滤、洗涤;
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O;
故答案为:Sn2++H2O2+2H+═Sn4++2H2O;
(7)由实验过程可知,发生的反应为:2Fe3++Sn2+=Sn4++2Fe2+,6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,则:
Sn2+~2Fe3+~2Fe2+~
| 1 |
| 3 |
1
| 1 |
| 3 |
n 0.0250L×0.100mol/L
解得n=0.0075mol,
100ml溶液中含有SnCl2 物质的量=0.0075mol×
| 100 |
| 25 |
SnCl2固体的纯度=
| 190g/mol×0.03mol |
| 6.0g |
答:SnCl2固体的纯度为95.00%.
点评:本题考查了物质分离的方法和实验操作,水解分析应用,滴定实验的计算判断和计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
下列物质中,物质的量为0.4mol的是( )
| A、6.4gO2 |
| B、1.1 gCO2 |
| C、7.2 gH2O |
| D、49 gH2SO4 |
已知①25℃、101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol ②25℃、101kPa下,碳的燃烧热是393.5kJ/mol.今有120g碳不完全燃烧,所得混合气体对氧气的相对密度为1.则该反应放出的热量是( )
| A、1105 kJ |
| B、1812.5 kJ |
| C、2520 kJ |
| D、3935 kJ |