题目内容
短周期元素X、Y、Z在元素周期表中的相对位置如图所示.
25℃,0.1mol?L-1M溶液(M为Y的最高价氧化物的水化物)的pH为13.
(1)Y的离子结构示意图为 .
(2)X、Z的气态氢化物稳定性较强的是 (填化学式).
(3)不能用带磨口玻璃塞的试剂瓶盛装M溶液的原因是 (用离子方程式表示).
(4)工业上,用X单质制取Z单质的化学方程式为 .
(5)X的最高价氧化物与某一元有机酸的钾盐(化学式为KA,A-为酸根)溶液反应的化学方程式为 .(已知25℃,X的最高价氧化物的水化物的电离常数为Kal=4.2×10-7,Ka2=5.6×10-11;HA的电离常数Ka=1.1×10-10)
| X | |||
| Y | Z |
(1)Y的离子结构示意图为
(2)X、Z的气态氢化物稳定性较强的是
(3)不能用带磨口玻璃塞的试剂瓶盛装M溶液的原因是
(4)工业上,用X单质制取Z单质的化学方程式为
(5)X的最高价氧化物与某一元有机酸的钾盐(化学式为KA,A-为酸根)溶液反应的化学方程式为
考点:位置结构性质的相互关系应用
专题:
分析:25℃,0.1mol?L-1 M溶液(M为Y的最高价氧化物所对应的水化物)的pH为13,说明M为强碱,由短周期元素X、Y、Z在元素周期表中的相对位置如,可推知Y是Na,X是C,Z是Si,以此解答该题.
解答:
解:25℃,0.1mol?L-1 M溶液(M为Y的最高价氧化物所对应的水化物)的pH为13,说明M为强碱,由短周期元素X、Y、Z在元素周期表中的相对位置如,可推知Y是Na,X是C,Z是Si,
(1)Y是Na,原子失去最外层1个电子形成钠离子,离子结构示意图为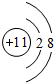 ,故答案为:
,故答案为: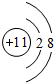 ;
;
(2)非金属性C>Si,故氢化物稳定性教强的是CH4,故答案为:CH4;
(3)M是NaOH溶液,玻璃中含有二氧化硅,在瓶口会发生反应SiO2+2OH-═SiO32-+H2O,故答案为:SiO2+2OH-═SiO32-+H2O;
(4)工业上,在高温下用C单质还原二氧化硅反应制取Si单质,反应化学方程式为2C+SiO2
2CO↑+Si,故答案为:2C+SiO2
2CO↑+Si;
(5)X的最高价氧化物的水化物的电离常数为Ka1=4.2×10-7,Ka2=5.6×10-11,HA的电离常数Ka=1.1×10-10,酸性H2CO3>HA>HCO3-,故X的最高价氧化物与KA反应生成KHCO3,故反应方程式为:KA+CO2+H2O═KHCO3+HA,
故答案为:KA+CO2+H2O═KHCO3+HA.
(1)Y是Na,原子失去最外层1个电子形成钠离子,离子结构示意图为
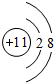 ,故答案为:
,故答案为: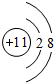 ;
;(2)非金属性C>Si,故氢化物稳定性教强的是CH4,故答案为:CH4;
(3)M是NaOH溶液,玻璃中含有二氧化硅,在瓶口会发生反应SiO2+2OH-═SiO32-+H2O,故答案为:SiO2+2OH-═SiO32-+H2O;
(4)工业上,在高温下用C单质还原二氧化硅反应制取Si单质,反应化学方程式为2C+SiO2
| ||
| ||
(5)X的最高价氧化物的水化物的电离常数为Ka1=4.2×10-7,Ka2=5.6×10-11,HA的电离常数Ka=1.1×10-10,酸性H2CO3>HA>HCO3-,故X的最高价氧化物与KA反应生成KHCO3,故反应方程式为:KA+CO2+H2O═KHCO3+HA,
故答案为:KA+CO2+H2O═KHCO3+HA.
点评:本题考查位置结构性质关系应用,为高频考点,侧重于学生的分析能力的考查,题目涉及常用化学用语、元素化合物性质、化学键、电离常数应用等,难度中等,(5)中注意根据电离平衡常数判断产物.

练习册系列答案
相关题目
 节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )| A、其分子式为C15H21O4 |
| B、1mol该物质与NaOH溶液反应,最多消耗2mol NaOH |
| C、既能发生加聚反应,又能发生酯化反应 |
| D、既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
水的电离平衡曲线如图所示.下列说法正确的是( )


| A、图中对应点的温度关系为:a>b>C |
| B、纯水仅升高温度,可从a点变到c点 |
| C、水的离子积常数KW数值大小关系为:b>c>d |
| D、在b点对应温度下,0.5mol/L的H2SO4溶液与1mol/L的KOH溶液等体积混合,充分反 应后,所得溶液的pH=7 |
 现有X、Y、Z、W原子序数依次增大的四种元素,常温下X元素单质的密度在自然界中最小,Y是短周期元素中未成对电子数与原子序数之比最大的原子,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等,且Y与Z可形成多种气态化合物,W是常见的有色可变价金属单质,常温下可溶于Y的最高价氧化物水化物中,其基态原子的内层轨道全部排满电子,且最外层电子数为1.
现有X、Y、Z、W原子序数依次增大的四种元素,常温下X元素单质的密度在自然界中最小,Y是短周期元素中未成对电子数与原子序数之比最大的原子,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等,且Y与Z可形成多种气态化合物,W是常见的有色可变价金属单质,常温下可溶于Y的最高价氧化物水化物中,其基态原子的内层轨道全部排满电子,且最外层电子数为1. 周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中的未成对电子有3个,C的s能级电子总数与p能级电子总数相等,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中的未成对电子有3个,C的s能级电子总数与p能级电子总数相等,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题: