题目内容
水的电离平衡曲线如图所示.下列说法正确的是( )


| A、图中对应点的温度关系为:a>b>C |
| B、纯水仅升高温度,可从a点变到c点 |
| C、水的离子积常数KW数值大小关系为:b>c>d |
| D、在b点对应温度下,0.5mol/L的H2SO4溶液与1mol/L的KOH溶液等体积混合,充分反 应后,所得溶液的pH=7 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.依据图象数据分析,纵轴是氢氧根离子浓度,横轴是氢离子浓度,水的离子积常数Kw=c(H+)×c(OH-)计算判断;
B.根据C点溶液的酸碱性判断;
C.温度越高,水的离子积常数越大;
D.b点Kw=10-12,中性溶液pH=6.
B.根据C点溶液的酸碱性判断;
C.温度越高,水的离子积常数越大;
D.b点Kw=10-12,中性溶液pH=6.
解答:
解:A.温度越高,水的离子积常数越大,根据图象知,b点Kw=10-12,c点Kw=10-13,a点Kw=10-14,所以b>c>a,故A错误;
B.c点Kw=10-13,则c曲线的纯水中6<pH<7,c点的pH=6,则该溶液呈酸性,所以纯水仅升高温度,不能从a点变到c点,故B错误;
C.a、d曲线温度相同,则离子积常数相同,即d点Kw=10-14,b点Kw=10-12,c点Kw=10-13,所以水的电离常数KW数值大小关系为:b>c>d,故C正确;
D.b点Kw=10-12,0.5mol/L的H2SO4溶液与1mol/L的KOH溶液等体积混合,氢离子浓度和氢氧根离子浓度相同,等体积混合溶液呈中性,pH=6,故D错误;
故选C.
B.c点Kw=10-13,则c曲线的纯水中6<pH<7,c点的pH=6,则该溶液呈酸性,所以纯水仅升高温度,不能从a点变到c点,故B错误;
C.a、d曲线温度相同,则离子积常数相同,即d点Kw=10-14,b点Kw=10-12,c点Kw=10-13,所以水的电离常数KW数值大小关系为:b>c>d,故C正确;
D.b点Kw=10-12,0.5mol/L的H2SO4溶液与1mol/L的KOH溶液等体积混合,氢离子浓度和氢氧根离子浓度相同,等体积混合溶液呈中性,pH=6,故D错误;
故选C.
点评:本题考查了水的电离、离子积的概念应用和影响条件,注意离子积常数是随温度变化的,不能根据氢离子浓度确定溶液酸碱性,为易错点.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
下列钠的化合物与其性质或用途不相符的是( )
| A、Na2O2-淡黄色固体,可用作漂白剂 |
| B、Na2O-白色固体,性质不稳定 |
| C、Na2CO3-性质稳定,可治疗胃酸过多 |
| D、NaHCO3-受热易分解,可用作发酵粉 |
A、B、C都是金属,把A浸入C的盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极.A、B、C金属的活动性顺序为( )
| A、B>A>C |
| B、A>C>B |
| C、A>B>C |
| D、B>C>A |
用惰性电极电解CuSO4溶液一段时间后,停止电解向所得溶液中加入0.2molCu(OH)2,恰好反应时溶液浓度恢复至电解前,关于电解过程说法不正确的是( )
| A、生成的铜的物质的量是0.2mol |
| B、随着电解进行溶液的pH减小 |
| C、转移电子的物质的量为0.4mol |
| D、阳极反应是40H--4e-=2H20+O2尹 |
下列有关原子结构、元素性质的说法正确的是( )
| A、Si、P、S、Cl元素的单质与氢气化合越来越容易 |
| B、元素原子最外层电子数越多,元素金属性越强 |
| C、元素周期表共有18列,第3列是第ⅠB族,第17列是第ⅦA族 |
| D、F-、O2-、Mg2+、Na+离子半径逐渐减小 |
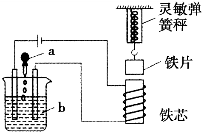 如图所示,向烧杯内的溶液b中逐渐加入溶液a时,灵敏弹簧秤的读数先逐渐变小然,然后又逐渐变大,则溶液a、b分别是( )
如图所示,向烧杯内的溶液b中逐渐加入溶液a时,灵敏弹簧秤的读数先逐渐变小然,然后又逐渐变大,则溶液a、b分别是( )| A、NaOH、H2SO4 |
| B、BaCl2、NaOH |
| C、Ba(OH)2、Na2SO4 |
| D、NH3?H2O、CH3COOH |