题目内容
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、用铜作电极电解饱和NaCl溶液,当线路中通过NA个电子时,阳极产生11.2L气体(标准状况下) |
| B、6.5g锌全部溶于一定量的浓硫酸,生成SO2与H2的混合气体,气体分子总数为0.1 NA |
| C、1.00 L 1.00 mol?L-1 Na2CO3溶液中,CO32-所带电荷总数为2NA |
| D、标准状况下,22.4 L HCl溶于水后溶液中含有nA个HCl分子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.铜做电极,阳极失去电子的为金属铜;
B.锌与浓硫酸反应生成二氧化硫,与稀硫酸反应生成氢气,1mol生成氢气和二氧化硫转移的电子数都是2mol;
C.CO32-是多元弱酸的酸根离子,部分水解生成碳酸氢根离子;
D.氯化氢为强电解质,溶于水完全电离生成氢离子与氯离子.
B.锌与浓硫酸反应生成二氧化硫,与稀硫酸反应生成氢气,1mol生成氢气和二氧化硫转移的电子数都是2mol;
C.CO32-是多元弱酸的酸根离子,部分水解生成碳酸氢根离子;
D.氯化氢为强电解质,溶于水完全电离生成氢离子与氯离子.
解答:
解:A.用铜作电极电解饱和NaCl溶液,阳极失去电子的是金属铜,不会生成气体,故A错误;
B.6.5g锌的物质的量为0.1mol,完全反应0.1mol锌失去0.2mol电子,根据电子守恒生成SO2与H2的混合气体的物质的量为0.1mol,气体分子总数为O.1NA,故B正确;
C.CO32-是多元弱酸的酸根离子,部分水解生成碳酸氢根离子所以1.00 L 1.00 mol?L-1 Na2CO3溶液中含有的碳酸根离子的物质的量小于1.00 L×1.00 mol?L-1,即小于1mol,则CO32-所带电荷总数小于2NA,故C错误;
D.氯化氢为强电解质,溶于水完全电离生成氢离子与氯离子,所以HCl溶于水后溶液不含氯化氢分子,故D错误;
故选:B.
B.6.5g锌的物质的量为0.1mol,完全反应0.1mol锌失去0.2mol电子,根据电子守恒生成SO2与H2的混合气体的物质的量为0.1mol,气体分子总数为O.1NA,故B正确;
C.CO32-是多元弱酸的酸根离子,部分水解生成碳酸氢根离子所以1.00 L 1.00 mol?L-1 Na2CO3溶液中含有的碳酸根离子的物质的量小于1.00 L×1.00 mol?L-1,即小于1mol,则CO32-所带电荷总数小于2NA,故C错误;
D.氯化氢为强电解质,溶于水完全电离生成氢离子与氯离子,所以HCl溶于水后溶液不含氯化氢分子,故D错误;
故选:B.
点评:本题考查了阿伏伽德罗常数,题目难度中等,注意电解质阳极若为活性电极,则电极本身放电.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
“神舟”五号载人飞船发射成功后,我国又在启动“嫦娥工程”,在3-4年内中国人登上月球.人类探测月球发现,其土壤中存在较丰富的质量数为3的氦,它可以作为核聚变的重要原料之一.以下叙述正确的是( )
| A、由质量数为3的氦原子构成的分子是双原子分子 |
| B、23He与24He的性质均相同 |
| C、23He中的质子数与24He的中子数相等 |
| D、23He、24He 形成的分子中存在共价键 |
下列各组物质中,无论以任何比例混合,其密度不变的是( )
| A、CO与C2H4 |
| B、C2H6与C2H4 |
| C、CO2与C3H6 |
| D、CH4与C2H4 |
下列分离物质的方法中,根据微粒大小进行分离的是( )
| A、萃取 | B、重结晶 | C、聚沉 | D、渗析 |
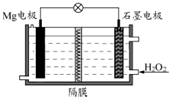 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A、Mg 电极是该电池的正极 |
| B、H2O2在石墨电极上发生还原反应 |
| C、石墨电极附近溶液的pH 减小 |
| D、溶液中Cl-向正极移动 |
下列分子式①C2H6O ②C4H10 ③N2 ④C ⑤CH4 ⑥P,表示的物质一定是纯净物的是( )
| A、③⑤⑥ | B、③⑤ |
| C、③④⑤⑥ | D、②③④⑤⑥ |
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、18g NH4+ 所含原子数为4NA |
| B、10g氖气所含原子数约为6.02×1023 |
| C、标准状况下,22.4L H2O所含的分子数为NA |
| D、常温常压下,32g O2和O3的混合气体所含原子数为2NA |
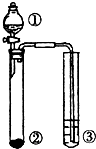 利用图示实验装置,能达到实验目标的是( )
利用图示实验装置,能达到实验目标的是( ) 某环烷烃的结构像红十字会的会徽,因此有人称它为“红十字烷”结构如图,其分子式为
某环烷烃的结构像红十字会的会徽,因此有人称它为“红十字烷”结构如图,其分子式为