题目内容
10.某同学用Na2CO3和NaHCO3溶液进行如图所示实验.下列说法中,正确的是( )
| A. | 实验前两溶液的pH相等 | |
| B. | 实验前两溶液中离子种类完全相同 | |
| C. | 加入CaCl2溶液后生成的沉淀一样多 | |
| D. | 加入CaCl2溶液后反应的离子方程式都是CO32-+Ca2+═CaCO3↓ |
分析 A.碳酸钠溶液中碳酸根离子水解程度大于碳酸氢根离子;
B.溶液中阴阳离子为碳酸根离子、碳酸氢根离子、氢氧根离子、钠离子和氢离子;
C.碳酸氢钠和氯化钙等物质的量混合生成碳酸钙沉淀、二氧化碳气体和水,碳酸钠和氯化钙反应生成沉淀是碳酸钙;
D.碳酸氢钠和氯化钙等物质的量混合生成碳酸钙沉淀、二氧化碳气体和水,碳酸钠和氯化钙反应生成碳酸钙沉淀.
解答 解:A.等浓度的Na2CO3和NaHCO3溶液中,碳酸钠溶液中碳酸根离子水解程度大于碳酸氢根离子,溶液PH不同.碳酸钠溶液PH大于碳酸氢钠,故A错误;
B.溶液中阴阳离子为碳酸根离子、碳酸氢根离子、氢氧根离子、钠离子和氢离子,实验前两溶液中离子种类完全相同,故B正确;
C.碳酸氢钠和氯化钙溶液反应,碳酸钠和氯化钙1:1反应生成碳酸钙沉淀,加入CaCl2溶液后生成的沉淀不一样多,故C错误;
D.加入CaCl2溶液后,碳酸钠溶液中反应的离子方程式都是CO32-+Ca2+═CaCO3↓,碳酸氢钠和氯化钙等物质的量混合生成碳酸钙沉淀、二氧化碳气体和水,反应的离子方程式为:2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O,故D错误;
故选B.
点评 本题考查了钠及其化合物性质,主要是碳酸钠和碳酸氢钠的性质对比,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
19.化学与生产、生活、社会密切相关,下列说法错误的是( )
| A. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| B. | 利用CO2合成聚碳酸酯类可降解塑料,有利于减少白色污染 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 我国汽油标准由“国III”提高到“国1V”,目的是减少有害气体的排放,改善环境质量 |
1.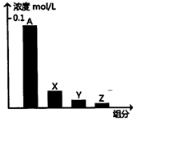 常温下,0.2mol/L的乙酸与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol/L的乙酸与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
 常温下,0.2mol/L的乙酸与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol/L的乙酸与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | A可能表示Na+ | |
| B. | A可能表示乙酸分子 | |
| C. | 若图中A表示CH3COO-,可以证明乙酸是弱酸 | |
| D. | 该混合溶液中:c(A)+c(Y)=c(X)+c(Z) |
18.下列对有机物结构或性质的描述中,错误的是( )
| A. | 乙醇通过消去反应可制得乙烯 | |
| B. | CH3CH=CHCH3分子中的4个碳原子在同一平面上 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| D. | 在溴水中加入苯,振荡后溴水的颜色变浅,这是由于发生了加成反应 |
5.化学与社会、生活密切相关.对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 光线透过树叶间的缝隙射入密林中时,会产生一道道光柱 | 气溶胶产生的丁达尔效应 |
| B | 炒菜时加碘盐要在菜准备出锅时添加 | 食盐中的碘受热易升华 |
| C | 明矾常用作净水剂 | 明矾具有杀菌消毒功能 |
| D | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 水果中的葡萄糖能与高锰酸钾发生氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
15.乙醇、正戊烷、苯是常见有机物,下列说法正确的是( )
| A. | 苯和溴水共热生成溴苯 | |
| B. | 2,2-二甲基丙烷是正戊烷的同系物 | |
| C. | 乙醇、正戊烷、苯均可通过石油的分馏得到 | |
| D. | 乙醇、正戊烷、苯均能发生取代反应和氧化反应 |
2.已知 25℃下时,NH3•H2O kb=1.77×10-5;H2CO3 ka1=4.30×10-7、ka2=5.61×10-11. 25℃时有关NH4HCO3溶液的说法中正确的是( )
| A. | 呈弱酸性 | |
| B. | c(OH-)+c(NH3•H2O)=c(H+)+c(H2CO3) | |
| C. | 滴入NaOH 溶液发生反应:NH4++OH-=NH3•H2O和HCO3-+OH-=H2O+CO32- | |
| D. | 滴入NaOH溶液,则$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$增大 |
19.设NA为阿伏加德罗常数的数值,下列有关叙述正确的是( )
| A. | 100g 98%的浓硫酸中含有的氢原子数目为2NA | |
| B. | 16g16O2和18O2的混合物中含有的质子数目为8NA | |
| C. | 电解精炼铜的过程中,若阳极减重64g,则电路中一定通过2NA个电子 | |
| D. | 取50ml14.0mol/L浓硝酸与足量的铜片反应,生成气体分子的数目可能为0.25NA |
20.小苏打是常用的食品添加剂,其化学式是( )
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2SO4 | D. | NaCl |