题目内容
用NA表示阿伏加德罗常数,下列说法中正确的有( )
| A、2.4g金属镁与足量盐酸反应,转移电子的数目为0.1NA |
| B、1mol/L的CaCl2溶液中含Cl-的数目为2NA |
| C、常温常压下,1.7gNH3中含N-H键数目为0.3 NA |
| D、标准状况下,11.2 L H2O含有的电子数为5 NA |
考点:阿伏加德罗常数
专题:
分析:A、根据反应后镁元素的价态来分析;
B、溶液体积不明确;
C、求出氨气的物质的量n=
,然后根据1mol氨气中安3molN-H键来分析;
D、标况下,水为液态.
B、溶液体积不明确;
C、求出氨气的物质的量n=
| m |
| M |
D、标况下,水为液态.
解答:
解:A、2.4g镁的物质的量为0.1mol,而反应后镁元素的价态为+2价,故0.1mol镁转移0.2mol电子,故A错误;
B、溶液体积不明确,无法计算溶液中氯离子的个数,故B错误;
C、氨气的物质的量n=
=
=0.1mol,而1mol氨气中安3molN-H键,故0.1mol氨气中含0.3molN-H键,故C正确;
D、标况下,水为液态,故11.2L水的物质的量不是0.5mol,故电子数不是5NA个,故D错误.
故选C.
B、溶液体积不明确,无法计算溶液中氯离子的个数,故B错误;
C、氨气的物质的量n=
| m |
| M |
| 1.7g |
| 17g/mol |
D、标况下,水为液态,故11.2L水的物质的量不是0.5mol,故电子数不是5NA个,故D错误.
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
一定温度下,某NaCl稀溶液中[H+]为1×10-6mol?L-1,下列说法正确的是( )
| A、该NaCl溶液显酸性 |
| B、该NaCl溶液中Kw=1×10-14mol2.L-2 |
| C、该NaCl溶液稀释10倍后pH=7 |
| D、该NaCl溶液中Kw=1×10-12mol2.L-2 |
现有等浓度的下列溶液:①醋酸,②次氯酸,③碳酸氢钠,④碳酸,⑤碳酸钠.按溶液pH由小到大排列正确的是( )
| A、④①②⑤③ |
| B、④①②③⑤ |
| C、①④②③⑤ |
| D、①④②⑤③ |
在m A+n B═p C的反应中,m、n、p为各物质的计量数.现测得C每分钟增加a mol?L-1,B每分钟减少1.5a mol?L-1,A每分钟减少0.5a mol?L-1,则m:n:p为( )
| A、2:3:2 |
| B、2:3:3 |
| C、1:3:2 |
| D、3:1:2 |
用NA表示阿伏加德罗常数.下列叙述正确的是( )
| A、1.0 L 0.1 mol/L的NH4Cl溶液中NH4+的数目为0.1NA |
| B、常温下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数为0.1NA |
| C、常温下,0.05 mol CO2和SO2混合气体中所含氧原子数为0.1NA |
| D、高温高压下,1.4 g N2与0.3 g H2反应,生成的NH3分子数为0.1NA |
下列电离方程式正确的是( )
| A、H2SO3?2H++SO32- |
| B、HF=H++F- |
| C、NaHS=Na++H++S2- |
| D、H2CO3+H2O?H3O++HCO3- |
高温下,某反应达平衡,平衡常数K=
.恒容时,温度升高,B的浓度减小.下列说法正确的是( )
①该反应的焓变为正值
②恒温恒容下,增大压强,B浓度一定减小
③升高温度,逆反应速率减小
④该反应化学方程式为C(g)+D(g)?A(g)+B(g)
⑤增加A的量,平衡向正反应方向移动
⑥加入催化剂,B的转化率提高.
| c(C)c(D) |
| c(A)c(B) |
①该反应的焓变为正值
②恒温恒容下,增大压强,B浓度一定减小
③升高温度,逆反应速率减小
④该反应化学方程式为C(g)+D(g)?A(g)+B(g)
⑤增加A的量,平衡向正反应方向移动
⑥加入催化剂,B的转化率提高.
| A、①③⑥ | B、①⑤ |
| C、①④⑤ | D、②⑤ |
下列实验操作或装置不符合实验要求的是( )
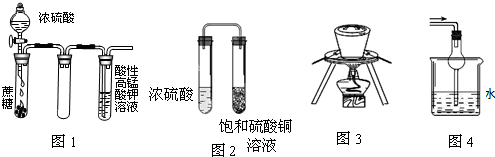

| A、图1酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
| B、图2久置后,饱和硫酸铜溶液可能析出蓝色晶体 |
| C、图3在海带提碘实验中用于灼烧海带 |
| D、图4可用于吸收易溶于水的尾气 |