题目内容
7.下列物质中,既含有离子键,又含有非极性共价键的是( )| A. | HCl | B. | KOH | C. | CaCl2 | D. | Na2O2 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,同种非金属元素之间形成非极性键,不同非金属元素之间形成极性键,铵根离子和酸根离子之间存在离子键,据此分析解答.
解答 解:A.HCl分子中H-Cl原子之间只存在极性键,故A错误;
B.KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,故B错误;
C.氯化钙中钙离子和氯离子之间只存在离子键,故C错误;
D.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,故D正确;
故选D.
点评 本题考查化学键,为高频考点,侧重考查学生分析判断能力,明确离子键和共价键区别是解本题关键,注意:不能根据是否含有金属元素判断离子键,易错选项是C,注意氯化钙中两个氯离子之间不存在化学键.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
18.下列物质中,不与水发生反应的是( )
| A. | CaO | B. | SiO2 | C. | CO2 | D. | SO2 |
15.NaCl是重要的化工原料,可以制备一系列物质.有关下列流程的说法中,正确的是( )

| A. | NaHCO3的热稳定性好 | |
| B. | 如图所示转化涉及的反应都是氧化还原反应 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
19.下列判断或实验方法合理的是( )
| A. | 检验溶液中是否含有Fe2+:依次加入氯水和KSCN溶液 | |
| B. | pH=2的溶液,可能大量含有:Na+、AlO2-、CO32-、SO32- | |
| C. | 在常温下加入铝粉有氢气放出,则溶液中可能大量含有:K+、Na+、OH-、Cl- | |
| D. | 使紫色石蕊试液变红色的溶液,可能大量含有:K+、Fe2+、Cl-、NO3- |
16.将20mL2.5mol/LNaOH溶液加水稀释到100mL,稀释后的溶液中NaOH的物质的量浓度为( )
| A. | 1.0mol/L | B. | 0.5mol/L | C. | 0.2mol/L | D. | 0.1mol/L |
9.室温下,用相同浓度的NaOH溶液,分别滴定100mL浓度均为0.1mol•L-1的三种酸(HM、HN和HR)溶液,滴定的曲线如图所示,下列判断错误的是( )

| A. | 三种酸的电离常数关系:KHM>KHN>KHR | |
| B. | pH=7时,三种溶液中:c(M-)>c(N-)>c(R-) | |
| C. | 滴定至P点时,溶液中:c(Na+)>c(N-)>c(HN)>c(H+)>c(OH-) | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(HM)+c(HN)+c(HR)=c(OH-)-c(H+) |
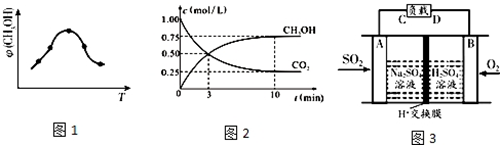

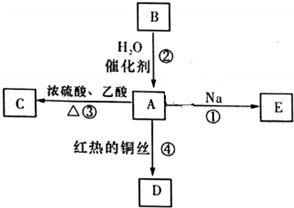 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应. .
.