题目内容
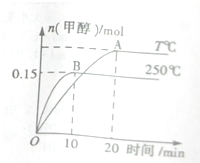 将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃下发生反应:CO(g)+2H2(g)?CH3OH(g)△H=a KJ?mol-1,如图所示,下列分析中正确的是( )
将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃下发生反应:CO(g)+2H2(g)?CH3OH(g)△H=a KJ?mol-1,如图所示,下列分析中正确的是( )| A、250℃时,0~10minH2反应速率为0.015mol?(L?Min)-1 |
| B、平衡时CO的转化率:T℃时小于250℃时 |
| C、a>0 |
| D、平衡常数K:T℃时大于250℃ |
考点:化学平衡的计算
专题:
分析:依据先拐先平的判断方法可知T<250℃,升高温度,甲醇物质的量减少,平衡逆移,所以正反应为放热反应,△H<0;
A.0~10min内甲醇物质的量增加了0.15mol,根据方程式求出氢气的变化量,再求速率;
B.已知该反应△H<0,而且T<250℃,温度越低CO的转化率越大;
C.正反应为放热反应,△H<0;
D.△H<0,升高温度,平衡逆向移动,K减小.
A.0~10min内甲醇物质的量增加了0.15mol,根据方程式求出氢气的变化量,再求速率;
B.已知该反应△H<0,而且T<250℃,温度越低CO的转化率越大;
C.正反应为放热反应,△H<0;
D.△H<0,升高温度,平衡逆向移动,K减小.
解答:
解:依据先拐先平的判断方法可知T<250℃,升高温度,甲醇物质的量减少,平衡逆移,所以正反应为放热反应,△H<0;
A.0~10min内甲醇物质的量增加了0.15mol,根据方程式氢气的变化量为:0.15mol×2=0.3mol,所以v(H2)=
=0.03mol/(L?min),故A错误;
B.已知该反应△H<0,而且T<250℃,温度越低CO的转化率越大,所以CO的转化率:T℃时大于250℃时,故B错误;
C.由以上分析可知△H<0,即a<0,故C错误;
D.正反应为放热反应,△H<0,即升高温度,平衡逆向移动,K减小,所以平衡常数K:T℃时大于250℃,故D正确;
故选D.
A.0~10min内甲醇物质的量增加了0.15mol,根据方程式氢气的变化量为:0.15mol×2=0.3mol,所以v(H2)=
| ||
| 10min |
B.已知该反应△H<0,而且T<250℃,温度越低CO的转化率越大,所以CO的转化率:T℃时大于250℃时,故B错误;
C.由以上分析可知△H<0,即a<0,故C错误;
D.正反应为放热反应,△H<0,即升高温度,平衡逆向移动,K减小,所以平衡常数K:T℃时大于250℃,故D正确;
故选D.
点评:本题考查物质的量随时间的变化图象,由明确图象中量的变化来分析反应速率、转化率、影响平衡的移动因素等,题目难度不大.

练习册系列答案
相关题目
一定能在下列溶液中大量共存的离子组是( )
| A、c(H+)=1×10-2mol?L-1的溶液:Na+、NH4+、CO32-、SO42- |
| B、水电离产生的c(H+)=1×10-12mol/L溶液:Fe2+、Ca2+、I-、NO3- |
| C、含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| D、能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32- |
Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下用足量CO还原,得到金属混合物2.39g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5g白色沉淀,则a的数值为( )
| A、3.41 | B、3.21 |
| C、3.19 | D、3.59 |
区别三种无色溶液NaCl、NaBr、NaI可选用( )
| A、AgNO3溶液 |
| B、氯水和酒精 |
| C、溴水和CCl4 |
| D、碘水和汽油 |
容量瓶上需标有以下五项中的( )
①温度②浓度③容量④压强⑤刻度线.
①温度②浓度③容量④压强⑤刻度线.
| A、①③⑤ | B、②③⑤ |
| C、①②③ | D、②③④ |