题目内容
1.如图表示某种盐B的制备及其性质的实验步骤: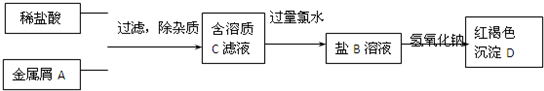
已知:盐B溶液呈棕黄色;沉淀D焙烧分解,生成红棕色固体E.
(1)请写出物质的化学式:
AFe,BFeCl3,CFeCl2,DFe(OH)3,
(2)检验B中阳离子的方法为加KSCN溶液,溶液变为血红色
(3)写出对应化学方程式
A→C:Fe+2HCl=FeCl2+H2↑,Fe(OH)2→D:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
(4)写出对应离子方程式C→B:2Fe2++Cl2=2Fe3++2Cl-.
分析 盐B溶液呈黄色,说明含有铁离子;沉淀D焙烧分解,生成红棕色粉末E,且D为红褐色,则D是Fe(OH)3,E为Fe2O3,根据反应过程中元素守恒知,金属单质A是Fe,铁和盐酸反应生成氯化亚铁和氢气,所以C是FeCl2,氯气具有强氧化性,亚铁离子具有还原性,氯气能将氯化亚铁氧化生成氯化铁,则B是FeCl3,结合物质的性质分析解答.
解答 解:(1)由以上分析可知A为Fe,B为FeCl3,C为FeCl2,D为Fe(OH)3,故答案为:Fe;FeCl3;FeCl2;Fe(OH)3;
(2)B为FeCl3,检验铁离子,可加KSCN溶液,溶液变为血红色,故答案为:加KSCN溶液,溶液变为血红色;
(3)铁和盐酸反应,发生Fe+2HCl=FeCl2+H2↑,氢氧化亚铁不稳定,可被氧化生成氢氧化铁,方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:Fe+2HCl=FeCl2+H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)亚铁离子与氯气反应生成铁离子,方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查了铁及其化合物之间的转化,为高考常见题型和高频考点,侧重考查学生的分析能力,明确铁及其化合物的性质是解本题关键,注意氢氧化亚铁转化为氢氧化铁的变化现象,难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
20.在0.1mo1•L-1NaHCO3溶液中,下列关系错误的是( )
| A. | c(Na+)=0.1 mo1•L-1 | B. | c(CO32-)>c(OH-) | ||
| C. | c(HCO3-)>c(CO32-) | D. | c(OH-)>c(H+) |
1.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作与现象 | 结论 |
| A | 将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液, 溶液变成红色 | Fe(NO3)2中一定含Fe3+ |
| B | 从煤油中取出一小块钠,用滤纸擦净表面的煤油, 放入无水乙醇中,产生气泡 | Na能置换出醇烃基中的氢 |
| C | 将某气体通入品红溶液,溶液褪色 | 气体一定是SO2 |
| D | 向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀 | AlO2-结合H+的能力比CO32-强 |
| A. | A | B. | B | C. | C | D. | D |
5.下列物质的每步转化在给定条件下能一步实现且较合理的是( )
| A. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| B. | 饱和食盐水$\stackrel{NH_{3}•CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{O_{2}•H_{2}O}{→}$HNO3 |
13.下列溶液中的氯离子浓度与50mL 1mol/L的AlCl3溶液中氯离子浓度相等的是( )
| A. | 150mL 1mol/L NaCl溶液 | B. | 75mL 3mol/L NH4Cl溶液 | ||
| C. | 150mL 2mol/L KCl溶液 | D. | 75mL 2mol/L CaCl2溶液 |
11.部分弱酸的电离常数如表:
下列有关说法不正确的是( )
| 弱酸 | HCOOH | HCN | H2S |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| A. | 等体积、等浓度的HCOONa和NaCN两溶液中所含阴离子数目相等 | |
| B. | HCOO-、CN-、HS-在溶液中可以大量共存 | |
| C. | NaHS溶液中加入适量KOH后:c(Na+)═c(H2S)+c(HS-)+C(S2-) | |
| D. | 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |