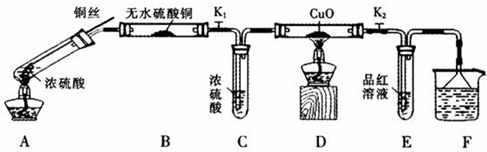
题目内容
下列说法中正确的是( )
| A、从1 L 1 mol/L的NaCl溶液中取出100 mL,其浓度为0.1 mol/L |
| B、配制0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L |
| C、0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 |
| D、10 g 98%的硫酸(密度为1.84 g/cm3)与10 mL 18.4 mol/L硫酸的浓度是不同的 |
考点:物质的量与其浓度和气体摩尔体积的综合应用
专题:物质的量浓度和溶解度专题
分析:A.根据溶液均一的性质判断;
B.气体存在的温度、压强未知,不能确定体积;
C.根据n=cV=
计算;
D.根据c=
计算.
B.气体存在的温度、压强未知,不能确定体积;
C.根据n=cV=
| N |
| NA |
D.根据c=
| 1000ρω |
| M |
解答:
解:A.溶液具有均一、稳定的性质,从1 L 1 mol/L的NaCl溶液中取出100 mL,其浓度仍为1 mol/L,故A错误;
B.气体存在的温度、压强未知,不能确定体积,故B错误;
C.0.5 L 2 mol/L BaCl2溶液中溶质的物质的量为0.5L×2mol/L=1mol,则Ba2+和Cl-的总物质的量为3mol,个数为3×6.02×1023,故C正确;
D.98%的硫酸(密度为1.84 g/cm3)的物质的量浓度为c=
=18.4mol/L,故D错误.
故选C.
B.气体存在的温度、压强未知,不能确定体积,故B错误;
C.0.5 L 2 mol/L BaCl2溶液中溶质的物质的量为0.5L×2mol/L=1mol,则Ba2+和Cl-的总物质的量为3mol,个数为3×6.02×1023,故C正确;
D.98%的硫酸(密度为1.84 g/cm3)的物质的量浓度为c=
| 1000×1.84g/L×98% |
| 98g/mol |
故选C.
点评:本题考查较为综合,为高考高频题型,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
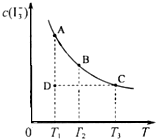 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq) 某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq) 某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A、反应I2(aq)+I-(aq)?I3-(aq)的△H>0 |
| B、若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2 |
| C、若反应进行到状态D时,平衡向逆反应方向移动 |
| D、状态B与状态C相比,状态C的c(I2)大 |
某氯化镁溶液的密度为1.2g?cm-3,其中镁离子的质量分数为5%,300mL该溶液中Cl-离子的物质的量约为( )
| A、0.37 mol |
| B、0.63mol |
| C、0.75mol |
| D、1.5mol |
当有机物分子中的一个碳原子所连接的四个原子或原子团均不相同时,此碳原子为“手性碳原子”,具有手性碳原子的物质往往具有旋光性,存在对映异构体,如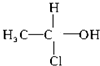 .下列化合物中存在对映异构体的是( )
.下列化合物中存在对映异构体的是( )
 .下列化合物中存在对映异构体的是( )
.下列化合物中存在对映异构体的是( )| A、C2H5CH=CHCH(CH3)-CH=CHC2H5 |
B、 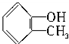 |
| C、甲酸 |
| D、C6H5CH(CH3)OCH3 |
下列说法正确的是( )
| A、1mol/L硫酸溶液所含的H+数约为1.204×1024个 |
| B、标准状况下气体摩尔体积约为22.4L |
| C、0.5 L 1 mol/L FeCl3溶液与0.2 L 1 mol/L KCl溶液中的Cl-的数目之比为15:2 |
| D、100 mL 1 mol/L NaCl溶液与50 mL 1 mol/L AlCl3溶液中Cl-物质的量浓度相等 |
向CuSO4的溶液中投入一小块金属钠,可观察到的现象是(双选)( )
| A、有较多的铜析出 |
| B、有气体产生 |
| C、有蓝色沉淀产生 |
| D、有白色沉淀产生 |
对某无色溶液进行酸碱性测定,测得结果呈强酸性.则下列各组离子一定不可能大量存在的是( )
| A、Mg2+、Ca2+、HCO3-、Cl- |
| B、Na+、Mg2+、Cl-、SO42- |
| C、K+、Fe3+、Cl-、SO42- |
| D、Ba2+、Al3+、Cl-、NO3- |