题目内容
下列比较,不正确的是( )
| A、金属性:Na>Mg>Al |
| B、原子半径:Na>S>O |
| C、碱性:KOH>NaOH>LiOH |
| D、酸性:HIO4>HBrO4>HClO4 |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A、同周期从左到右金属性减弱;
B、电子层数越多原子半径越大,电子层数相同时,原子序数越大,半径越小;
C、金属性越强,对应的氢氧化物的碱性越强;
D、非金属性越强,对应最高价氧化物的水化物的酸性越强.
B、电子层数越多原子半径越大,电子层数相同时,原子序数越大,半径越小;
C、金属性越强,对应的氢氧化物的碱性越强;
D、非金属性越强,对应最高价氧化物的水化物的酸性越强.
解答:
解:A、同周期从左到右金属性减弱,则金属性:Na>Mg>Al,故A正确;
B、电子层数越多原子半径越大,原子半径:S>O,电子层数相同时,原子序数越大,半径越小,则原子半径:Na>S,所以原子半径:Na>S>O,故B正确;
C、金属性越强,对应的氢氧化物的碱性越强,金属性:K>Na>Li,则碱性:KOH>NaOH>LiOH,故C正确;
D、非金属性越强,对应最高价氧化物的水化物的酸性越强,非金属性:Cl>Br>I,则酸性:HIO4<HBrO4<HClO4,故D错误.
故选D.
B、电子层数越多原子半径越大,原子半径:S>O,电子层数相同时,原子序数越大,半径越小,则原子半径:Na>S,所以原子半径:Na>S>O,故B正确;
C、金属性越强,对应的氢氧化物的碱性越强,金属性:K>Na>Li,则碱性:KOH>NaOH>LiOH,故C正确;
D、非金属性越强,对应最高价氧化物的水化物的酸性越强,非金属性:Cl>Br>I,则酸性:HIO4<HBrO4<HClO4,故D错误.
故选D.
点评:本题考查了金属性、非金属性、原子半径等的大小比较,侧重元素周期律的应用的考查,题目难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
下列有关电化学的叙述正确的是( )
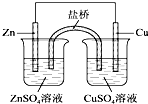

| A、为实现铁上镀铜,可把铁作为阳极 |
| B、氯碱工业通过电解熔融的NaCl生产Cl2 |
| C、如图所示,盐桥中的K+移向ZnSO4溶液 |
| D、氢氧燃料电池(碱性电解质溶液)中O2通入正极,电极反应为O2+2H2O+4e-═4OH- |
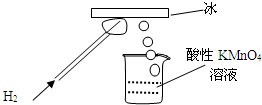 某研究性学习小组做了一个如图所示的实验,在导管口点燃氢气后,发现烧杯中酸性溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.下列判断正确的是
某研究性学习小组做了一个如图所示的实验,在导管口点燃氢气后,发现烧杯中酸性溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.下列判断正确的是( )
| A、该条件下H2燃烧放出的热量使冰分解产生了氧气 |
| B、该条件下H2被冷却为液态氢,液氢的水溶液具有氧化性 |
| C、该条件下生成的物质具有氧化性和还原性 |
| D、该条件下生成的水分子化学性质比较活泼 |
第三周期元素X、Y、Z可分别形成Xn+、Ym+、Zn-三种离子,已知m>n,且三种元素相应的最高价氧化物对应水化物两两之间会发生反应.下列说法中不正确的是( )
| A、Y为Al |
| B、Z的最高价氧化物对应水化物的分子式为HClO4 |
| C、X与Z结合形成离子化合物 |
| D、X、Y、Z原子半径Z>X>Y |
锎是一种放射性元素,该元素的一种核素在医学上常用作治疗恶性肿瘤的中子源.下列说法正确的是( )
A、
| ||||
B、
| ||||
C、
| ||||
| D、锎元素的相对原子质量为252 |