题目内容
下列有关电化学的叙述正确的是( )
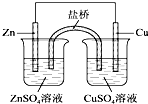

| A、为实现铁上镀铜,可把铁作为阳极 |
| B、氯碱工业通过电解熔融的NaCl生产Cl2 |
| C、如图所示,盐桥中的K+移向ZnSO4溶液 |
| D、氢氧燃料电池(碱性电解质溶液)中O2通入正极,电极反应为O2+2H2O+4e-═4OH- |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、电镀时,镀层金属是阳极,镀件是阴极;
B、电解熔融的NaCl生产Cl2和金属钠,氯碱工业可以产生氢氧化钠、氢气和氯气;
C、原电池中的阳离子移向正极;
D、氢氧燃料电池的正极上是氧气得电子的还原反应.
B、电解熔融的NaCl生产Cl2和金属钠,氯碱工业可以产生氢氧化钠、氢气和氯气;
C、原电池中的阳离子移向正极;
D、氢氧燃料电池的正极上是氧气得电子的还原反应.
解答:
解:A、电镀时,镀层金属是阳极,镀件是阴极,铁上镀铜,可把铁作为阴极,故A错误;
B、电解熔融的NaCl生产Cl2和金属钠,氯碱工业是电解饱和食盐水产生氢氧化钠、氢气和氯气的工业,故B错误;
C、原电池中的阳离子移向正极,锌铜原电池中,锌是负极,铜是正极,盐桥中的K+移向CuSO4溶液,故C错误;
D、氢氧燃料电池的正极上是氧气得电子的还原反应,在碱性环境下,电极反应为:O2+2H2O+4e-═4OH-,故D正确.
故选D.
B、电解熔融的NaCl生产Cl2和金属钠,氯碱工业是电解饱和食盐水产生氢氧化钠、氢气和氯气的工业,故B错误;
C、原电池中的阳离子移向正极,锌铜原电池中,锌是负极,铜是正极,盐桥中的K+移向CuSO4溶液,故C错误;
D、氢氧燃料电池的正极上是氧气得电子的还原反应,在碱性环境下,电极反应为:O2+2H2O+4e-═4OH-,故D正确.
故选D.
点评:本题考查学生原电池以及电解池工作原理的应用知识,注意知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
C4H10的一氯取代物共有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
下列说法正确的是( )
| A、BaSO4是强电解质 |
| B、CO是酸性氧化物 |
| C、氢氧化铁胶体属于纯净物 |
| D、纯碱属于碱类物质 |
设NA为阿伏加德罗常数,下列叙述正确的是( )
| A、80gNH4NO3 中含有氮原子数为2NA |
| B、1Llmol?L-1盐酸中含有氯化氢分子数为NA |
| C、标准状况下,11.2LCCl4 所含分子数为0.5NA |
| D、铁在氯气中燃烧,1lmolFe失去的电子数为2NA |
NaCl的摩尔质量是( )
| A、58.5 |
| B、58.5g |
| C、58.5g/mol |
| D、58.5mol |
下列反应过程中的能量变化符合如图情况的是( )


| A、酸与碱的中和反应 |
| B、Ba(OH)2?8H2O与NH4Cl的反应 |
| C、镁和盐酸的反应 |
| D、酒精燃烧 |
下列对物质的结构组成表示恰当的是( )
| A、H2O2的结构式:H-O-H-O |
B、硫离子的结构示意图: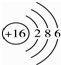 |
C、二氧化碳的比例模型: |
| D、氧化铁的化学式:FeO |
下列比较,不正确的是( )
| A、金属性:Na>Mg>Al |
| B、原子半径:Na>S>O |
| C、碱性:KOH>NaOH>LiOH |
| D、酸性:HIO4>HBrO4>HClO4 |
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.