题目内容
下列关于钠的说法中错误的是( )
| A、钠元素以化合态存在在自然界中 |
| B、钠可以从硫酸铜溶液中还原出铜单质 |
| C、钠在氯气中燃烧产生大量的白烟 |
| D、金属钠有强的还原性 |
考点:钠的化学性质
专题:金属概论与碱元素
分析:A.钠性质很活泼,在常温下,易和氧气、水反应,所以钠不能在自然界中以游离态存在;
B.钠与水剧烈反应,投入硫酸铜溶液中反应生成氢气和氢氧化铜;
C.钠在氯气中燃烧生成白色的烟氯化钠固体;
D.金属钠的结构决定金属钠的性质,金属钠在反应中只能失电子;
B.钠与水剧烈反应,投入硫酸铜溶液中反应生成氢气和氢氧化铜;
C.钠在氯气中燃烧生成白色的烟氯化钠固体;
D.金属钠的结构决定金属钠的性质,金属钠在反应中只能失电子;
解答:
解:A.钠最外层电子少,易失去,易被氧化,从而性质活泼,在自然界中只能以化合物的形式存在,故A正确;
B.钠投入硫酸铜溶液中首先与水反应生成氢气和氢氧化钠,氢氧化钠和硫酸铜反应生成氢氧化铜,故B错误;
C.钠和氯气在点燃的条件下反应2Na+Cl2
2NaCl白色的烟为氯化钠固体,故C正确;
D.钠原子最外层只有一个电子,金属钠在反应中容易失电子,具有强还原性,故D正确;
故选B.
B.钠投入硫酸铜溶液中首先与水反应生成氢气和氢氧化钠,氢氧化钠和硫酸铜反应生成氢氧化铜,故B错误;
C.钠和氯气在点燃的条件下反应2Na+Cl2
| ||
D.钠原子最外层只有一个电子,金属钠在反应中容易失电子,具有强还原性,故D正确;
故选B.
点评:本题考查钠的性质,侧重于元素化合物知识的综合考查与应用,有利于培养学生的良好的科学素养和提高学生学习的积极性,题目难度不大.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
已知在比较酸的强弱时,必须考虑两方面:一是电离出氢离子的能力,二是溶剂接受氢离子的能力.比如HCl在水中是强酸,在冰醋酸中就是弱酸;而HAc在水中是弱酸,在液氨中却是强酸,就是因为接受氢离子的能力:NH3>H2O>HAc.下列关于酸性强弱的说法正确的是( )
| A、在A溶剂中,甲的酸性大于乙;在B的溶剂中,甲的酸性可能小于乙 |
| B、比较HCl、H2SO4、HClO4、HNO3酸性的强弱,用水肯定不可以,用冰醋酸可能可以 |
| C、HNO3在HClO4中是酸,在H2SO4中可能是碱 |
| D、比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
下列各组微粒中,互为同位素的是( )
| A、金刚石和石墨 | ||||
B、
| ||||
| C、D2O和H2O | ||||
D、
|
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).能判断该反应是否达到化学平衡状态的依据是( )
| A、容器中压强不变 |
| B、单位时间内消耗了n mol CO2,同时生成了n mol H2O |
| C、v正(H2)=v逆(H2O) |
| D、c(CO2)=c(CO) |
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、标准状况下,22.4L CCl4含有NA个分子 |
| B、常温常压下46g NO2和N2O4混合气体含有3NA个原子 |
| C、0.1mol AlCl3完全转化为氢氧化铝胶体,生成0.lNA个胶体粒子 |
| D、0.1mol Cl2与足量NaOH溶液反应,转移电子数为0.2NA |
某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3:1.用石墨作电极电解该混合溶液时,根据电极产物,可明显分为三个阶段.下列叙述不正确的是( )
| A、阴极自始自终只析出H2 |
| B、阳极先析出O2,后析出C12 |
| C、电解最后阶段为电解水 |
| D、溶液pH不断增大,最后为7 |
可逆反应A(g)+2B(g)?3C(g)+4D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
| A、v(A)=0.15 mol/(L?min ) |
| B、v(B)=0.5 mol/(L?min) |
| C、v(C)=0.4 mol/(L?min) |
| D、v(D)=0.02 mol/(L?s) |

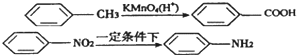
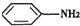 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)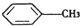 与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.