题目内容
10.从海水提取溴的过程中,有如下反应:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O,与上述反应在原理上最相似的反应是( )| A. | 2NaBr+Cl2═Br2+2NaCl | |
| B. | AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl | |
| C. | 2H2S+SO2═3S↓+2H2O | |
| D. | Cl2+H2O═HCl+HClO |
分析 题干中的反应为氧化还原反应,只有溴元素的化合价发生变化,是高价+5价和低价-1价均变为0价的一种氧化还原反应,属于氧化还原反应中的归中反应类型.
解答 解:A、发生化合价变化的是氯元素和溴元素,属于普通的氧化还原反应,故A错误;
B、没有元素化合价发生变化,不是氧化还原反应,故B错误;
C、只有硫元素的化合价发生变化,高价+4价和低价-2价均变为0价,属于氧化还原反应中的归中反应类型,故C正确;
D、只有Cl元素的化合价发生变化,0价变成+1价和低价-1价,属于氧化还原反应中的歧化反应类型,故D错误.
故选C.
点评 本题考查学生分析和解决问题的能力,考查学生氧化还原反应知识,难度不大.

练习册系列答案
相关题目
14. 国产航母001A等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为:
国产航母001A等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为:
Zn+2CuSO4+2NaOH=Cu2O+ZnSO4+Na2SO4+H2O.该反应的下列说法正确的是( )
 国产航母001A等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为:
国产航母001A等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为:Zn+2CuSO4+2NaOH=Cu2O+ZnSO4+Na2SO4+H2O.该反应的下列说法正确的是( )
| A. | Zn得到电子 | B. | CuSO4被氧化 | C. | NaOH是还原剂 | D. | CuSO4是氧化剂 |
5.下列反应的离子方程式正确的是( )
| A. | 石灰石溶于稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 氧化镁与稀硫酸:MgO+2H+═Mg2++H2O | |
| D. | 常温下,将铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
15.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 加入H+能产生无色无味气体的溶液:OH-、K+、I-、SO32- | |
| B. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| C. | 0.1 mol•L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 在澄清透明的无色溶液中:Na+、Cu2+、Cl-、NO3- |
2.下列各组离子能大量共存,当溶液中c(H+)=10-1mol/L时,有气体产生;而当溶液中c(H+)=10-13mol/L时,又能生成沉淀.该组离子可能是( )
| A. | Fe2+、Na+、SO42-、NO3- | B. | Al3+、K+、Cl-、HCO3- | ||
| C. | Na+、Fe3+、NO3-、CO32- | D. | Mg2+、NH4+、SO42-、Cl- |
19.下列有关说法正确的是( )
| A. | 在稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热等于57.3kJ | |
| B. | 在一密闭容器中发生反应2SO2+O2?2SO3,增大压强,平衡正向移动,K增大 | |
| C. | 2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则C的燃烧热△H=-110.5 kJ•mol-1 | |
| D. | 向稀硫酸中加入少量硫酸铜可提高锌与稀硫酸反应生成氢气的速率 |
20.以硼镁泥(主要成分为MgSiO3、Fe2O3及少量Al2O3、FeO和MnO)为原料制备高纯Mg(OH)2的流程如图1:
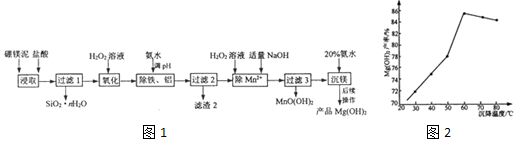
己知:
①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如表所示:
②温度高于340℃时Mg(OH)2开始分解为MgO和H2O.
(1)“浸取”时,为提高镁的浸取率可行的措施为ac
a.将硼镁泥制成浆料 b.降低浸取温度 c.用盐酸多次浸取
(2)“浸取”时,MgSiO3与盐酸反应的化学方程式为MgSiO3+2HCl+(n-l)H2O=MgCl2+SiO2•nH2O
(3)“除铁、铝”时,需调节溶液pH范围为4.7<pH<7.1.
(4“除Mn2+”时发生反应的离子方程式为Mn2++H2O2+2OH-=MnO(OH)2↓+H2O;过滤3所得滤渣中含有MnO(OH)2和Mg(OH)2.
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图2所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是氨水挥发加剧,导致溶液中氨水浓度降低.

己知:
①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如表所示:
| pH值 | Mg(OH)2 | Mn(OH)2 | MnO(OH)2 | Fe(OH)2 | Al(OH)3 | Fe(OH)3 |
| 开始沉淀时 | 9.3 | 7.1 | 7.8 | 7.6 | 3.7 | 2.3 |
| 沉淀完全时 | 10.8 | 10.8 | 9.8 | 9.6 | 4.7 | 3.7 |
(1)“浸取”时,为提高镁的浸取率可行的措施为ac
a.将硼镁泥制成浆料 b.降低浸取温度 c.用盐酸多次浸取
(2)“浸取”时,MgSiO3与盐酸反应的化学方程式为MgSiO3+2HCl+(n-l)H2O=MgCl2+SiO2•nH2O
(3)“除铁、铝”时,需调节溶液pH范围为4.7<pH<7.1.
(4“除Mn2+”时发生反应的离子方程式为Mn2++H2O2+2OH-=MnO(OH)2↓+H2O;过滤3所得滤渣中含有MnO(OH)2和Mg(OH)2.
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图2所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是氨水挥发加剧,导致溶液中氨水浓度降低.
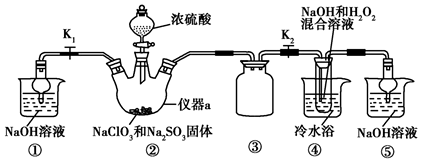
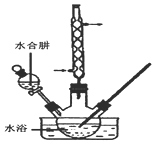 碘化钠是一种白色结晶粉末,医疗上可用于甲状腺肿瘤防治剂、祛痰剂等.实验室用NaOH、单质碘和水合肼为原料制得,部分装置如图所示.
碘化钠是一种白色结晶粉末,医疗上可用于甲状腺肿瘤防治剂、祛痰剂等.实验室用NaOH、单质碘和水合肼为原料制得,部分装置如图所示.