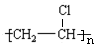题目内容
5.下列反应的离子方程式正确的是( )| A. | 石灰石溶于稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 氧化镁与稀硫酸:MgO+2H+═Mg2++H2O | |
| D. | 常温下,将铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
分析 A.二者反应生成氯化钙、二氧化碳和水;
B.漏掉氢氧根离子与铜离子的反应;
C.二者反应生成硫酸镁和水;
D.电荷不守恒.
解答 解:A.石灰石溶于稀盐酸,离子方程式:CaCO3+2H+═Ca2++CO2↑+H2O,故A正确;
B.硫酸铜溶液与氢氧化钡溶液反应,离子方程式:2OH-+Cu2++Ba2++SO42-═BaSO4↓+Cu(OH)2↓,故B错误;
C.氧化镁与稀硫酸,离子方程式:MgO+2H+═Mg2++H2O,故C正确;
D.常温下,将铜片插入硝酸银溶液中,离子方程式:Cu+2Ag+═Cu2++2Ag,故D错误;
故选:AC.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意离子反应遵循客观事实、遵循原子个数、电荷守恒规律,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
9.既可用排水法又可用向上排空气法收集的气体是( )
| A. | NO | B. | O2 | C. | NH3 | D. | NO2 |
7.“碳呼吸电池”是一种新型能源装置,其工作原理如图.下列说法正确的是( )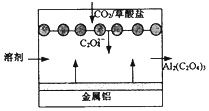

| A. | 该装置是将电能转变为化学能 | |
| B. | 正极的电极反应为:C2O42--2e-=2CO2 | |
| C. | 每得到1 mol草酸铝,电路中转移3 mol电子 | |
| D. | 利用该技术可捕捉大气中的CO2 |
10.从海水提取溴的过程中,有如下反应:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O,与上述反应在原理上最相似的反应是( )
| A. | 2NaBr+Cl2═Br2+2NaCl | |
| B. | AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl | |
| C. | 2H2S+SO2═3S↓+2H2O | |
| D. | Cl2+H2O═HCl+HClO |
17.下列叙述错误的是( )
| A. | 共价化合物中只含共价键 | |
| B. | 离子化合物中可能含有共价键 | |
| C. | 干冰变为二氧化碳气体,因共价键被破坏需吸收能量 | |
| D. | 碳酸氢铵受热分解产生氨气不仅破坏离子键还破坏了共价键 |
14.下列指定反应的离子方程式正确的是( )
| A. | 向FeCl3溶液中滴加HI溶液:Fe3++2I-═Fe2++I2 | |
| B. | 用铜电极电解氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2 Na+ |
15.下列有关二氧化硫的说法正确的是( )
| A. | 密度比空气小 | |
| B. | 是无色无味的气体 | |
| C. | SO2能使溴水褪色,说明SO2具有漂白性 | |
| D. | 某生产硫酸厂区紫罗兰花变成白色,说明其周围空气中可能含较高浓度SO2 |
 乙烯是石油化工的重要产品,以乙烯为原料制备一些化工产品的流程如图:
乙烯是石油化工的重要产品,以乙烯为原料制备一些化工产品的流程如图: