题目内容
4. 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.(1)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H1=-860.0kJ•mol-1
②2NO2(g)?N2O4(g)△H2=-66.9kJ•mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(g)、CO2的热化学方程式:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=-793.1kJ/mol.
(2)如将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图甲.电极a、b表面发生电极反应.其中a极为:负极,b其电极反应式为:CO2+2H++2e-=HCOOH.
(3)如果用100ml 1.5mol/L的NaOH溶液吸收2.24L(标准状况)的二氧化碳气体所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)(用离子浓度符号表示).
(4)燃料除硫中可用到CaCO3,它是一种难溶物质,其Ksp=2.8×10-9.
①石灰石-石膏湿法烟气脱硫工艺技术的工作原理是烟气中的二氧化硫与浆液中的碳酸钙及鼓入的空气反应生成石膏(CaSO4•2H2O).写出该反应的化学方程式:2CaCO3+2SO2+O2+4H2O═2(CaSO4•2H2O)+2CO2.
②有一纯碱溶液的浓度为2×10-4mo1/L,现将其与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为5.6×10-5mo1/L.
分析 (1)根据题意写出化学方程式,再根据盖斯定律运用“加减法”求算此反应的焓变;
(2)a极将水反应生成氧气,氧元素化合价升高,失去电子,所以为负极.b为正极,是二氧化碳得到电子生成甲酸,据此解答;
(3)标准状况下2.24LCO2的物质的量为0.1L,1.5mol/LNaOH溶液中含有0.15molNaOH,二者恰好发生反应2CO2+3NaOH=Na2CO3+NaHCO3+H2O,反应后生成了等浓度的碳酸钠和碳酸氢钠,然后结合盐的水解原理判断各离子浓度大小;
(4)①碳酸钙与二氧化硫、氧气反应生成硫酸钙和二氧化碳;
②②Na2CO3溶液的浓度为1×10-4mol/L,等体积混合后溶液中c(CO32-)=5.0×10-5mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答 解:(1)①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H1=-860.0kJ•mol-1;
②2NO2(g)?N2O4(g)△H2=-66.9kJ•mol-1,
依据盖斯定律①-②得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=△H1-△H2=-793.1kJ/mol;
故答案为:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=-793.1 kJ/mol;
(2)a极将水反应生成氧气,氧元素化合价升高,失去电子,所以为负极,b为正极,是二氧化碳得到电子生成甲酸,电极反应为:CO2+2H++2e-=HCOOH;
故答案为:负极;CO2+2H++2e-=HCOOH;
(3)标准状况下,2.24LCO2的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,
100mL 1.5mol/LNaOH溶液中含有0.15molNaOH,二者发生反应2CO2+3NaOH=Na2CO3+NaHCO3+H2O生成等浓度的Na2CO3、NaHCO3,HCO3-、CO32-部分水解,溶液呈碱性,则c(OH-)>c(H+),由于CO32-水解程度大于HCO3-,则c(HCO3-)>c(CO32-),所以反应后溶液中的离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(4)①石灰石-石膏湿法烟气脱硫工艺技术的工作原理是烟气中的二氧化硫与浆液中的碳酸钙及鼓入的空气反应生成石膏(CaSO4•2H2O),即碳酸钙与二氧化硫、氧气反应生成硫酸钙和二氧化碳,其反应的方程式为:2CaCO3+2SO2+O2+4H2O═2(CaSO4•2H2O)+2CO2;
故答案为:2CaCO3+2SO2+O2+4H2O═2(CaSO4•2H2O)+2CO2;
②Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=$\frac{2.8×10{\;}^{-9}}{1×10{\;}^{-4}}$mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为5.6×10-5mol/L;
故答案为:5.6×10-5mo1/L.
点评 本题考查了反应热的计算、电极判断及电极反应式的书写、离子浓度大小比较、难溶电解质的溶解平衡,明确盖斯定律计算反应热方法、原电池工作原理、碳酸钠和碳酸氢钠水解性质、溶度积规则是解题关键,题目难度中等.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案| A. | 铁 | B. | 熔融的氢氧化钠 | C. | 食盐水 | D. | 硫酸 |
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑(取代反应) | |
| B. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH(加成反应) | |
| C. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O(取代反应) | |
| D. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O(加成反应) |
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,Cu2++2HS-═CuS↓+H2S↑ | |
| C. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
| A. | 最高价氧化物对应水化物的酸性:W>Z>X | |
| B. | 化合物Q有强氧化性 | |
| C. | Z、X都可以形成两种常见的酸性氧化物 | |
| D. | 四种元素的常见单质中X的单质的沸点最高 |
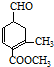 )、乙(
)、乙(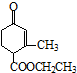 )两种有机物,下列说法中不正确的是( )
)两种有机物,下列说法中不正确的是( )| A. | 可用新制的氢氧化铜悬浊液区分这两种有机物 | |
| B. | 1 mol甲与H2在一定条件下反应,最多消耗3 mol H2 | |
| C. | 甲、乙互为同分异构体 | |
| D. | 等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同 |

| A. | 反应Ⅰ的离子方程式为2OH-+Al2O3═2AlO2-+H2O | |
| B. | 操作a的内容包括:通入过量CO2、过滤、洗涤、灼烧 | |
| C. | 操作b为电解熔融状态的Al2O3或用CO还原Al2O3 | |
| D. | 固体b灼烧后与铝反应可用于工业上冶炼相应的金属 |
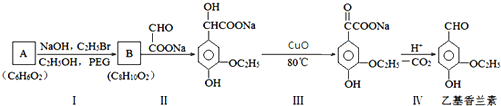
 .
.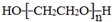 .若PEG的平均相对分子质量为17618,则其平均聚合度约为400.
.若PEG的平均相对分子质量为17618,则其平均聚合度约为400.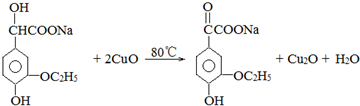 .
.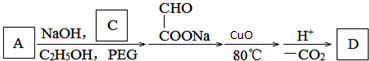
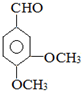 .
.