题目内容
14.已知分解1mol KClO3放出热量38.8kJ,在MnO2下加热,KClO3的分解机理为:①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
| A. | 1 mol KClO3所具有的总能量高于1 mol KCl所具有的总能量 | |
| B. | KClO3分解速率快慢主要取决于反应① | |
| C. | 1 g KClO3,1 g MnO2,0.1 g Mn2O7混合加热,充分反应后MnO2质量为1 g | |
| D. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 |
分析 A.分解1mol KClO3放出热量38.8kJ,可知分解反应为放热反应;
B.慢反应为决定反应速率的主要因素;
C.由反应②可知,Mn2O7分解会生成一部分MnO2;
D.催化剂的接触面积增大,可加快反应速率.
解答 解:A.反应2KClO3=2KCl+3O2为放热反应,故1 mol KClO3所具有的总能量高于1 mol KCl和1.5 mol O2所具有的总能量之和,故A正确;
B.由分解机理可知,KClO3的分解速率取决于慢反应,即反应①,故B正确;
C.由反应②可知,0.1 g Mn2O7分解会生成一部分MnO2,故反应后MnO2的总质量大于1 g,故C错误;
D.由分解机理可知,KClO3的分解速率取决于慢反应,即反应①,将固体二氧化锰碾碎,可加快反应①的反应速率,故D正确;
故选C.
点评 本题考查反应速率的影响因素及反应机理,为高频考点,把握发生的反应、速率的决定因素、影响反应速率的因素为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的易错点,题目难度不大.

练习册系列答案
相关题目
5.下列有关胶体的叙述正确的是( )
| A. | Fe(OH)3胶体有丁达尔效应是Fe(OH)3胶体区别于FeCl3溶液最本质的特征 | |
| B. | 阳光穿透清晨的树林时形成的光柱,是胶体的丁达尔效应的体现 | |
| C. | 鸡蛋清溶液分类上属于悬浊液 | |
| D. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色Fe(OH)3胶体 |
19.下列有关实验操作或叙述正确的是( )
①医院用银氨溶液检验某病人是否患糖尿病
②乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
③淀粉水解时应用浓硫酸作催化剂
④在鸡蛋白溶液中滴入浓HNO3,微热会产生黄色物质
⑤在植物油中滴入溴水,溴水褪色
⑥用盐析法可分离和提纯蛋白质.
①医院用银氨溶液检验某病人是否患糖尿病
②乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
③淀粉水解时应用浓硫酸作催化剂
④在鸡蛋白溶液中滴入浓HNO3,微热会产生黄色物质
⑤在植物油中滴入溴水,溴水褪色
⑥用盐析法可分离和提纯蛋白质.
| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①③⑤⑥ | D. | ①②③⑤ |
14.下列不属于同分异构体的组合是:( )
| A. | 戊烷与乙烷 | B. | 淀粉和纤维素 | C. |  | D. | CH3CH2CH2CH3和 |
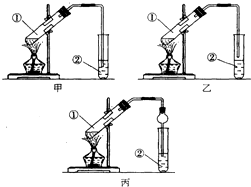 下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.
下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.