题目内容
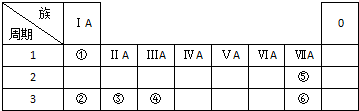 下表列出了①~⑥六种元素在周期表中的位置.
下表列出了①~⑥六种元素在周期表中的位置.请按要求回答下列问题.
(1)元素③与⑥形成的化合物中的化学键类型为
(2)在相同条件下,元素②、③、④的单质分别与盐酸反应最缓慢的是(填写化学式)
(3)元素⑤、⑥的气态氢化物中稳定性较强的是(填写化学式)
(4)将一小块元素②的单质放在石棉网上,用酒精灯微热,待其熔成球状时,将盛有元素⑥单质的集气瓶迅速倒扣在它的上方.写出该反应的化学方程式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,①为H、②为Na、③为Mg、④为Al、⑤为F、⑥为Cl,
(1)元素③与⑥形成的化合物为NaCl,属于离子化合物;元素①与⑤形成的化合物为HF,分子中H原子与F原子之间形成1对共用电子对;
(2)同周期自左而右金属性减弱,与盐酸反应的剧烈程度减弱,最高价氧化物对应水化物的碱性减弱;
(3)同主族自上而下非金属性减弱,气态氢化物的稳定性减弱;
(4)钠在氯气中燃烧生成氯化钠.
(1)元素③与⑥形成的化合物为NaCl,属于离子化合物;元素①与⑤形成的化合物为HF,分子中H原子与F原子之间形成1对共用电子对;
(2)同周期自左而右金属性减弱,与盐酸反应的剧烈程度减弱,最高价氧化物对应水化物的碱性减弱;
(3)同主族自上而下非金属性减弱,气态氢化物的稳定性减弱;
(4)钠在氯气中燃烧生成氯化钠.
解答:
解:由元素在周期表中的位置可知,①为H、②为Na、③为Mg、④为Al、⑤为F、⑥为Cl,
(1)元素③与⑥形成的化合物为NaCl,属于离子化合物,含有离子键;元素①与⑤形成的化合物为HF,分子中H原子与F原子之间形成1对共用电子对,其电子式为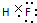 ,
,
故答案为:离子键;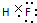 ;
;
(2)Na、Mg、Al同周期,自左而右金属性减弱,与盐酸反应的剧烈程度减弱,最高价氧化物对应水化物的碱性减弱,故Al与盐酸最缓慢,NaOH的碱性最强,
故答案为:Al;NaOH
(3)F、Cl同主族,自上而下非金属性减弱,气态氢化物的稳定性减弱,故HF更稳定,
故答案为:HF;
(4)钠在氯气中燃烧生成氯化钠,反应方程式为:2Na+Cl2
2NaCl,
故答案为:2Na+Cl2
2NaCl.
(1)元素③与⑥形成的化合物为NaCl,属于离子化合物,含有离子键;元素①与⑤形成的化合物为HF,分子中H原子与F原子之间形成1对共用电子对,其电子式为
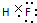 ,
,故答案为:离子键;
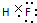 ;
;(2)Na、Mg、Al同周期,自左而右金属性减弱,与盐酸反应的剧烈程度减弱,最高价氧化物对应水化物的碱性减弱,故Al与盐酸最缓慢,NaOH的碱性最强,
故答案为:Al;NaOH
(3)F、Cl同主族,自上而下非金属性减弱,气态氢化物的稳定性减弱,故HF更稳定,
故答案为:HF;
(4)钠在氯气中燃烧生成氯化钠,反应方程式为:2Na+Cl2
| ||
故答案为:2Na+Cl2
| ||
点评:本题考查元素周期表与元素周期律的综合应用,比较基础,注意对基础知识理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,工作原理如图如示.下列有关说法正确的是( )

| A、当有0.2 mol电子转移时,a电极产生2.24 L H2 |
| B、b电极上发生的电极反应式为2H++2e-═H2↑ |
| C、d电极上发生的电极反应式为O2+4H++4e-═2H2O |
| D、d电极上进行氧化反应,B池中的H+可以通过隔膜进入A池 |
在一个2L的容器中,放入2mol气体A,5分钟后,测得这种气体A还剩余0.5mol,该反应中气体A的化学反应速率是( )
| A、1.5mol/(L?min) |
| B、0.15mol/(L?min) |
| C、0.75mol/(L?min) |
| D、0.075mol/(L?min) |
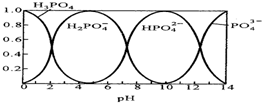 磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:
磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图: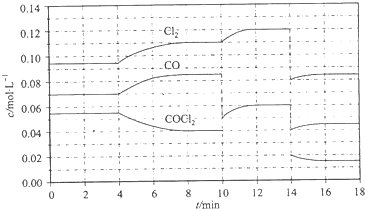 光气 (COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气 (COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.