题目内容
可逆反应①X(g)+2Y(g)?2Z(g)、②2M(g)?N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板.反应开始和达到平衡状态时有关物理量的变化如图所示:
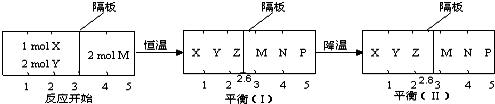
则:(1)达平衡(I)时体系的压强与反应开始时体系的压强之比为
(2)达平衡(I)时,X的转化率为
(3)X(g)+2Y(g)?2Z(g)是 热反应.

则:(1)达平衡(I)时体系的压强与反应开始时体系的压强之比为
(2)达平衡(I)时,X的转化率为
(3)X(g)+2Y(g)?2Z(g)是
考点:化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据等温时,反应②中气体的物质的量不变,压强与体积成反比,并且左右两个容器中的压强关系可判断;
(2)相同压强下,根据物质的量之比等于体积之比计算①中气体的物质的量,进而求出转化率;
(3)从降温导致平衡(Ⅰ)向平衡(Ⅱ)移动时,X、Y、Z的总物质的量变化导致反应移动的方向来判断反应是吸热还是放热.
(2)相同压强下,根据物质的量之比等于体积之比计算①中气体的物质的量,进而求出转化率;
(3)从降温导致平衡(Ⅰ)向平衡(Ⅱ)移动时,X、Y、Z的总物质的量变化导致反应移动的方向来判断反应是吸热还是放热.
解答:
解:(1)、平衡时,右边物质的量不变,由图可以看出达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为:
=
;
故答案为:
;
(2)、达平衡(Ⅰ)时,右边气体的物质的量不变,仍为2mol,左右气体压强相等,设平衡时左边气体的物质的量为xmol,
则有:
=
,x=
=
mol,即物质的量减少了3-
=
mol,反应特征分析减少量是反应的X的量,所以达平衡(Ⅰ)时,X的转化率为
×100%=83.3%;
故答案为:83.3%;
(1)、降温由平衡(Ⅰ)向平衡(Ⅱ)移动,同时X、Y、Z的总物质的量增大,说明平衡向左移动,正反应为吸热反应;
故答案为:吸热.
| 2 |
| 2.4 |
| 5 |
| 6 |
故答案为:
| 5 |
| 6 |
(2)、达平衡(Ⅰ)时,右边气体的物质的量不变,仍为2mol,左右气体压强相等,设平衡时左边气体的物质的量为xmol,
则有:
| 2 |
| x |
| 2.4 |
| 2.6 |
| 2×2.6 |
| 2.4 |
| 13 |
| 6 |
| 13 |
| 6 |
| 5 |
| 6 |
| ||
| 1mol |
故答案为:83.3%;
(1)、降温由平衡(Ⅰ)向平衡(Ⅱ)移动,同时X、Y、Z的总物质的量增大,说明平衡向左移动,正反应为吸热反应;
故答案为:吸热.
点评:本题考查化学平衡移动问题,具有一定难度,做题注意从右边反应体系中的物质的量不变考虑.

练习册系列答案
相关题目
25℃时,将0.2mol KF固体溶于100mL 1mol?L-1 HBr溶液中,加水稀释得到1L溶液,若此溶液中c(F-)>c(Br-),下列判断不正确的是( )
| A、该溶液的pH小于7 |
| B、c(HF)+c(F-)=0.2 mol?L-1 |
| C、c(HF)<c(F-) |
| D、c(F-)+c(OH-)=0.1 mol?L-1 |
某化学兴趣小组学习原电池知识后,决定用其原理,尝试利用铁粉、活性炭、无机盐等物质开发产品.小组提出的设想或对原理的理解不正确的是( )
| A、打算制成小包装用于糕点的脱氧剂 |
| B、利用反应放出热量的原理制成暖宝宝 |
| C、调整电池结构,可降低温度,可用于延长糕点保质期 |
| D、正极的电极反应为:2H2O+O2+4e-=4OH- |
如图实验装置设计,能达到目的是( )
A、 验证乙酸、碳酸和苯酚的酸性强弱 |
B、 实验室制取乙酸丁酯 |
C、 测定乙醇结构式 |
D、 验证溴乙烷中的溴原子 |




 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式: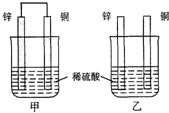 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.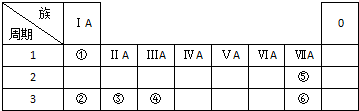 下表列出了①~⑥六种元素在周期表中的位置.
下表列出了①~⑥六种元素在周期表中的位置.