题目内容
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
A、D
| ||
| B、相同物质的量的OH-和CH3+含有相同数目的电子 | ||
| C、NA个H2分子与0.5 NA个CO分子所占的体积比一定是2:1 | ||
| D、25℃时,pH=1的H2SO4溶液中含有H+的数目为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、质子数+中子数=质量数,结合化学式计算判断;
B、1molOH-含10mol电子,1molCH3+含8mol电子;
C、气体的体积与温度和压强有关;
D、pH计算氢离子浓度,依据n=cV计算溶质物质的量.
B、1molOH-含10mol电子,1molCH3+含8mol电子;
C、气体的体积与温度和压强有关;
D、pH计算氢离子浓度,依据n=cV计算溶质物质的量.
解答:
解:A、D216O分子中质量数之和=20,质子数之和10,质量数之和是质子数之和的两倍,故A正确;
B、1molOH-含10mol电子,1molCH3+含8mol电子,故B错误;
C、气体的体积与温度和压强有关,未标明温度和压强,所以气体摩尔体积未知,导致两种气体体积无法计算,故C错误;
D、pH=1的溶液中c(H+)=0.1mol/L,1.0 L H2SO4溶液中含有的H+的数目为0.1NA,故D错误;
故选A.
B、1molOH-含10mol电子,1molCH3+含8mol电子,故B错误;
C、气体的体积与温度和压强有关,未标明温度和压强,所以气体摩尔体积未知,导致两种气体体积无法计算,故C错误;
D、pH=1的溶液中c(H+)=0.1mol/L,1.0 L H2SO4溶液中含有的H+的数目为0.1NA,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
实验室中金属钠保存在煤油中,若将一小块金属钠露置于空气中发生一系列变化,最终产物是( )
| A、NaOH |
| B、Na2O |
| C、Na2O2 |
| D、Na2CO3 |
对于同质量的SO2和SO3,下列说法正确的是( )
| A、硫元素的质量之比为5:4 |
| B、分子数之比为1:1 |
| C、氧原子数之比为2:3 |
| D、体积之比为5:4 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、1 mol?L-1NaCl溶液中含有Cl-的个数为NA |
| B、5.6g金属铁与盐酸反应失去的电子数为0.2NA |
| C、标准状况下,22.4L的水中含有的原子数为3NA |
| D、常温常压下,11.2L氯气中所含的原子数为NA |
下列反应的离子方程式正确的是( )
| A、硫酸铜溶液与烧碱溶液反应:Cu2++2OH-═Cu(OH)2↓ |
| B、石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ |
| C、碳酸钡与硫酸反应:Ba2++SO42-═BaSO4↓ |
| D、氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
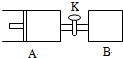 如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )
如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )| A、反应速率:v(B)>v(A) |
| B、A容器中X的转化率为80% |
| C、平衡时的压强:PB=2PA |
| D、平衡时Y的体积分数:A<B |
Cu与浓硝酸发生如下反应;Cu+4HNO3═Cu﹙NO3﹚2+2NO2↑+2H2O,被63.5铜还原的硝酸的质量是( )
| A、63g | B、126g |
| C、189g | D、252g |