题目内容
12. 右图是用点滴板探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板.下列对实验现象的解释正确的是( )
右图是用点滴板探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板.下列对实验现象的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 红色石蕊试纸变蓝 | NH3极易溶于水 |
| B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
| C | 氯化铝溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH-→Al(OH)3↓ |
| D | 浓盐酸附近有白烟 | NH3与挥发出的HCl反应:NH3+HCl→NH4Cl |
| A. | A | B. | B | C. | C | D. | D |
分析 NaOH固体溶于水放热,氨水易挥发,实验时向NaOH固体上滴几滴浓氨水,会产生氨气,为碱性气体,能使湿润的红色石蕊试纸变蓝,与浓硫酸发生中和反应生成硫酸铵,与氯化物发生复分解反应生成氢氧化物,氨水易挥发,与浓盐酸反应生成氯化铵,反应现象是有白烟生成.
解答 解:A、氨气使湿润的红色石蕊试纸变蓝的原因是与水反应生成NH3•H2O,电子生成OH-离子,溶液呈碱性,而不是NH3极易溶于水,故A错误;
B、氨气为碱性气体,与浓硫酸发生中和反应生成硫酸铵,故B错误;
C、氨气与氯化铝发生复分解反应生成氢氧化物,如氯化物溶液变浑浊,可能生成难溶性氢氧化铝,Al3++3NH3•H2O→Al(OH)3↓+3NH4+,故C错误;
D、NaOH固体溶于水放热,氨水易挥发,实验时向NaOH固体上滴几滴浓氨水,会产生氨气,与浓盐酸反应生成氯化铵,反应现象是有白烟生成,故D正确.
故选D.
点评 本题考查氨气的性质,题目难度不大,本题易错点为C项,注意氨气与NH3•H2O的性质区别.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
2.某元素原子最外层只有1个电子,它跟ⅥA元素相结合时,所形成的化学键( )
| A. | 一定是共价键 | B. | 一定是离子键 | ||
| C. | 可能是共价键、也可能是离子键 | D. | 以上说法均不正确 |
20.下列实验操作能够达到实验目的是( )


| A. | 实验室采用图①所示装置收集SO2 | |
| B. | 用图②所示装置,分离CCl4萃取I2水后的有机层和水层 | |
| C. | 除去NaHCO3溶液中的Na2CO3可加入Ca(OH)2溶液后过滤 | |
| D. | 称取0.40gNaOH,放入100mL容量瓶中,配制0.10mol•L-1的NaOH溶液 |
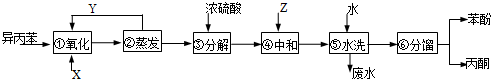
17.异丙苯 (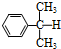 )氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下:
)氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下:
氧化: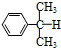 +O→
+O→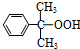 (异丙苯过氧氢)
(异丙苯过氧氢)
分解: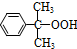 $→_{50-60℃}^{H+}$
$→_{50-60℃}^{H+}$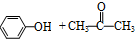 (丙嗣)
(丙嗣)
已知:
完成下列填空:
(1)X物质是氧气(或空气);Y物质是异丙苯.
(2)浓硫酸的作用是催化剂,其优点是用量少,可能的缺点是浓硫酸会使有机物发生脱水等副反应(浓硫酸与有机物混合放出大量热,使反应温度过高,不利于反应进行;或浓硫酸会腐蚀设备等)(写一条).
(3)Z物质最适宜选择c(选填编号).
a.NaOH b.Na2CO3 c.NaHCO3 d.CaCO3
(4)步骤⑥分馏,工业上在分馏塔中进行,如图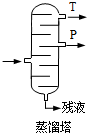 ,产品T是丙酮,
,产品T是丙酮,
请说明理由丙酮的沸点低.废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定:
①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:
c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶.
②充分反应后,稍松开瓶塞,从瓶塞和瓶壁间缝隙迅速加入10%KI溶液10mL(过量),迅速加盖,充分摇匀.加入少许淀粉溶液.
③用0.0250mol/LNa2S2O3标准溶液滴定至终点.用去Na2S2O3溶液22.48mL.
(5)已知:BrO3-+5Br-+6H+→3Br2+3H2O;写出苯酚与浓溴水反应的化学方程式 ;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.
;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.
(6)已知:I2+2Na2S2O3→2NaI+Na2S4O6;滴定终点的现象是由蓝色变为无色(或白色浑浊)且半分钟内不变色;该废水中苯酚的浓度是0.0053mol/L(保留4位小数).
 )氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下:
)氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下:氧化:
 +O→
+O→ (异丙苯过氧氢)
(异丙苯过氧氢)分解:
 $→_{50-60℃}^{H+}$
$→_{50-60℃}^{H+}$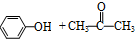 (丙嗣)
(丙嗣)
| 物质 | 丙酮 | 苯酚 | 异丙苯 |
| 密度(g/mL) | 0.7898 | 1.0722 | 0.8640 |
| 沸点/°C | 56.5 | 182 | 153 |
完成下列填空:
(1)X物质是氧气(或空气);Y物质是异丙苯.
(2)浓硫酸的作用是催化剂,其优点是用量少,可能的缺点是浓硫酸会使有机物发生脱水等副反应(浓硫酸与有机物混合放出大量热,使反应温度过高,不利于反应进行;或浓硫酸会腐蚀设备等)(写一条).
(3)Z物质最适宜选择c(选填编号).
a.NaOH b.Na2CO3 c.NaHCO3 d.CaCO3
(4)步骤⑥分馏,工业上在分馏塔中进行,如图
 ,产品T是丙酮,
,产品T是丙酮,请说明理由丙酮的沸点低.废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定:
①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:
c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶.
②充分反应后,稍松开瓶塞,从瓶塞和瓶壁间缝隙迅速加入10%KI溶液10mL(过量),迅速加盖,充分摇匀.加入少许淀粉溶液.
③用0.0250mol/LNa2S2O3标准溶液滴定至终点.用去Na2S2O3溶液22.48mL.
(5)已知:BrO3-+5Br-+6H+→3Br2+3H2O;写出苯酚与浓溴水反应的化学方程式
 ;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.
;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.(6)已知:I2+2Na2S2O3→2NaI+Na2S4O6;滴定终点的现象是由蓝色变为无色(或白色浑浊)且半分钟内不变色;该废水中苯酚的浓度是0.0053mol/L(保留4位小数).
4.根据碳原子的成键特点,甲烷分子中形成共价键的数目为( )
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
1.某小组同学采用以下装置验证SO2的性质:(夹持及加热装置略)
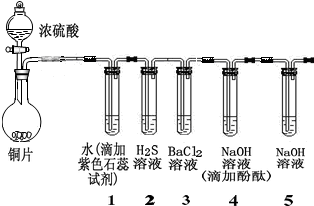
(1)写出圆底烧瓶中发生反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)从实验目的分析,试管1、4的目的都是为了证明SO2具有酸性氧化物的通性(性质),试管2是为了证明SO2具有氧化性(性质).
(3)除上述两种性质外,你认为SO2还具有的性质是还原性(或漂白性),可以通过加入KMnO4溶液(或品红)(填试剂化学式或者名称)加以证明.
(4)经过实验,观察到如下实验现象:
①试管1中紫色石蕊溶液变红.
②试管2中有浅黄色浑浊出现,写出反应的化学方程式2H2S+SO2=3S↓+2H2O.
(5)试管4中无明显现象,将其分成两份,分别加入下列物质均产生沉淀.将产生的沉淀的化学式填入下表相应位置.
(6)试管4和试管5均加入NaOH溶液,在实验目的上的不同点是3是验证性质,5是吸收.

(1)写出圆底烧瓶中发生反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)从实验目的分析,试管1、4的目的都是为了证明SO2具有酸性氧化物的通性(性质),试管2是为了证明SO2具有氧化性(性质).
(3)除上述两种性质外,你认为SO2还具有的性质是还原性(或漂白性),可以通过加入KMnO4溶液(或品红)(填试剂化学式或者名称)加以证明.
(4)经过实验,观察到如下实验现象:
①试管1中紫色石蕊溶液变红.
②试管2中有浅黄色浑浊出现,写出反应的化学方程式2H2S+SO2=3S↓+2H2O.
(5)试管4中无明显现象,将其分成两份,分别加入下列物质均产生沉淀.将产生的沉淀的化学式填入下表相应位置.
| 加入的物质 | O2 | 氨水 |
| 沉淀的化学式 |
2.常温下,下列各组离子在指定溶液中,一定可以大量共存的是( )
| A. | 无色溶液中 Mg2+、Al3+、SO42-、CO32- | |
| B. | pH=1的溶液中 NH4+、Ba2+、HCO3-、NO3- | |
| C. | 含MnO4-的溶液中 H+、K+、Br-、I- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中 Na+、K+、CH3COO-、SO42- |
 电池的发明和应用是化学家们对人类社会的重要贡献之一.
电池的发明和应用是化学家们对人类社会的重要贡献之一.