题目内容
 A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000mL,其pH的变化如图所示,则下列判断正确的是( )
A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000mL,其pH的变化如图所示,则下列判断正确的是( )| A、原酸溶液的浓度c(A)=c(B) |
| B、原酸溶液的浓度c(A)>c(B) |
| C、若a=5,则A为强酸,B为弱酸 |
| D、若2<a<5,则A、B都是弱酸,酸性A<B |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:pH=2的两种酸稀释1000倍时,弱酸中存在电离平衡,加水稀释促进弱电解质电离,导致溶液的pH小于5,强酸溶液的pH=5,稀释过程中,弱酸的电离导致稀释后溶液的pH小于强酸的变化程度,根据图象知,A的酸性大于B,
A.pH相等的两种酸,强酸的浓度小于弱酸;
B.pH相等的两种酸,强酸的浓度小于弱酸;
C.若pH=5,完全电离的为强酸,存在电离平衡的为弱酸;
D.若2<a<5,说明两种酸中都存在电离平衡,根据pH变化大小确定酸的强弱.
A.pH相等的两种酸,强酸的浓度小于弱酸;
B.pH相等的两种酸,强酸的浓度小于弱酸;
C.若pH=5,完全电离的为强酸,存在电离平衡的为弱酸;
D.若2<a<5,说明两种酸中都存在电离平衡,根据pH变化大小确定酸的强弱.
解答:
解:A.根据图象知,A酸pH变化大,B酸pH变化小,说明A的酸性大于B,pH相等的两种酸,弱酸的浓度大于强酸,所以原酸溶液的浓度c(A)<c(B),故A错误;
B.根据A知,原酸溶液的浓度c(A)<c(B),故B错误;
C.若a=5,稀释1000倍后氢离子浓度变为原来的千分之一,所以A为强酸,B的pH小于A,说明B中存在电离平衡,则B为弱酸,故C正确;
D.若2<a<5,说明两种酸中都存在电离平衡,则A、B都是弱酸,A溶液的pH变化大于B,所以酸性A>B,故D错误;
故选C.
B.根据A知,原酸溶液的浓度c(A)<c(B),故B错误;
C.若a=5,稀释1000倍后氢离子浓度变为原来的千分之一,所以A为强酸,B的pH小于A,说明B中存在电离平衡,则B为弱酸,故C正确;
D.若2<a<5,说明两种酸中都存在电离平衡,则A、B都是弱酸,A溶液的pH变化大于B,所以酸性A>B,故D错误;
故选C.
点评:本题考查酸的稀释及图象,明确强酸在稀释时pH变化程度大及酸的浓度与氢离子的浓度的关系是解答本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图所示各种装置中能构成原电池的是( )

| A、①②③ | B、④⑤⑥ |
| C、①③⑤ | D、②④⑥ |
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe 有关该电池的下列叙述中,正确的是( )
| A、负极的电极反应式为Li-e-=Li+ |
| B、该电池的电解质溶液可以用稀硫酸 |
| C、电池内部Li+向负极移动 |
| D、充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
2012年11月有媒体报道,我国内蒙古发现了世界级铀矿,内含有可用作核反应堆燃料的
U.
U原子核内的质子数为( )
235 92 |
235 92 |
| A、92 | B、143 |
| C、235 | D、327 |
在下列下列说法正确的是( )
| A、加入铝粉生成H2的溶液中,K+、Cu2+、SO42-、ClO-能大量共存 |
| B、在c(OH-)=10-2 mol?L-1的溶液中,NO3-、Ba2+、Cl-、Br-能大量共存 |
| C、0.1 mol/L Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
| D、0.1 mol/L Na2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-) |
在下列溶液中,可能大量共存的离子组是( )
A、使石蕊试液变红的溶液:Na+、K+、NO
| ||||
B、常温下,由水电离出的c(H+)=10-14mo1?L-1的溶液:K+、Na+、HCO
| ||||
C、与铝反应放出氢气的溶液:K+、A13+、SO
| ||||
D、含有大量Fe3+的溶液:Na+、Mg2+、NO
|
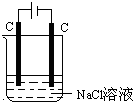 图为电解饱和食盐水示意图,下列说法正确的是( )
图为电解饱和食盐水示意图,下列说法正确的是( )| A、阳上析出氢气 |
| B、阴极上发生氧化反应 |
| C、电解时,溶液的pH增大 |
| D、与电源正极相连的是电解池的阴极 |
