题目内容
科研及生产中常涉及氮及其化合物.
(1)硝酸工业的重要反应之一是2NO(g)+O2(g)═2NO2(g).800℃时在2L密闭容器中加入0.020mol NO和0.010mol O2,n(NO)随时间的变化如表:
①800℃时该反应的平衡常数K= .已知反应的平衡常数K(700℃)>K(800℃),则该反应是 热反应.
②0~2s内该反应的平均速率v(O2)= .下列能说明该反应已经达到平衡状态的是 .
a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是 .
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效的催化剂
(2)肼(N2H4)可用做发射卫星的火箭燃料.已知:
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ?mol-1
写出气态肼和NO2生成氮气和水蒸气的热化学方程式 .
(3)肼-空气燃料电池的电解质溶液是20%~30%的KOH溶液,反应方程式是:
N2H4+O2=N2+2H2O,该燃料电池的负极电极反应式是 .
(1)硝酸工业的重要反应之一是2NO(g)+O2(g)═2NO2(g).800℃时在2L密闭容器中加入0.020mol NO和0.010mol O2,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.006 | 0.004 | 0.004 | 0.004 |
②0~2s内该反应的平均速率v(O2)=
a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效的催化剂
(2)肼(N2H4)可用做发射卫星的火箭燃料.已知:
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ?mol-1
写出气态肼和NO2生成氮气和水蒸气的热化学方程式
(3)肼-空气燃料电池的电解质溶液是20%~30%的KOH溶液,反应方程式是:
N2H4+O2=N2+2H2O,该燃料电池的负极电极反应式是
考点:化学平衡状态的判断,用盖斯定律进行有关反应热的计算,常见化学电源的种类及其工作原理,化学平衡常数的含义,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)①依据化学平衡三段式解释计算平衡浓度,结合平衡常数概念计算得到,温度越高平衡常数越小,说明平衡逆向进行,正反应是放热反应;
②依据图表数据计算一氧化氮的反应速率,结合反应速率之比等于化学方程式系数之比计算氧气反应速率;反应达到平衡的标志是正逆反应速率相同,个组成含量不变,分析“变量不变”来判断选项;
③反应是气体体积减小的放热反应,依据化学平衡移动原理分析判断;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式:
(3)燃料电池中燃料在负极失电子发生氧化反应,依据电解质溶液中的离子减小电荷配平书写电极反应.
②依据图表数据计算一氧化氮的反应速率,结合反应速率之比等于化学方程式系数之比计算氧气反应速率;反应达到平衡的标志是正逆反应速率相同,个组成含量不变,分析“变量不变”来判断选项;
③反应是气体体积减小的放热反应,依据化学平衡移动原理分析判断;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式:
(3)燃料电池中燃料在负极失电子发生氧化反应,依据电解质溶液中的离子减小电荷配平书写电极反应.
解答:
解:(1)①800℃时在2L密闭容器中加入0.020mol NO和0.010mol O2,
2NO(g)+O2(g)═2NO2(g)
起始量(mol/L) 0.01 0.005 0
变化量(mol/L) 0.008 0.004 0.008
平衡量(mol/L) 0.002 0.001 0.008
K=
=16000L?mol-1;
反应的平衡常数K(700℃)>K(800℃),温度升高平衡常数减小,平衡逆向进行,逆向是吸热反应,正反应是放热反应,
故答案为:16000L?mol-1;放;
②0~2s内该反应的平均速率v(O2)=
V(NO)=
×
=1.75×10-3mol?L-1?s-1;
下列能说明该反应已经达到平衡状态的判断依据,反应达到平衡的标志是正逆反应速率相同,个组成含量不变,分析“变量不变”来判断选项;
a.速率之比等于化学方程式系数之比,v(NO2)=2v(O2)表示的是正反应速率之比,不能说明反应达到平衡,故a错误;
b.反应前后是气体体积变化的反应,容器内压强保持不变,说明反应达到平衡状态,故b正确;
c.速率之比等于化学方程式系数之比,v(NO2)=2v(O2)表示的是正反应速率之比,v逆(NO)=2v正(O2),说明一氧化氮的正逆反应速率相同,反应达到平衡状态,故c正确;
d.反应前后气体质量不变,容器体积不变,密度始终不变,容器内的密度保持不变不能说明反应达到平衡状态,故d错误;
故答案为:1.75×10-3mol?L-1?s-1;bc;
③为使该反应的反应速率增大,且平衡向正反应方向移动的;
a.及时分离出NO2气体,平衡正向进行,但反应速率减小,故a不符合;
b.反应是放热反应,适当升高温度,速率增大,但平衡逆向进行,故b不符合;
c.增大O2的浓度平衡正向进行,反应速率增大,故c符合;
d.选择高效的催化剂只能改变反应速率不能改变平衡,故d不符合;
故答案为:c;
(2)①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ?mol-1
由盖斯定律计算②×2-①得到气态肼和NO2生成氮气和水蒸气的热化学方程式:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1153.7kJ?mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1153.7kJ?mol-1;
(3)N2H4+O2=N2+2H2O,强碱溶液中发生的原电池反应中,燃料在负极失电子发生氧化反应,该燃料电池的负极电极反应式是N2H4+4OH--4e-=N2+4H2O,
故答案为:N2H4+4OH--4e-=N2+4H2O.
2NO(g)+O2(g)═2NO2(g)
起始量(mol/L) 0.01 0.005 0
变化量(mol/L) 0.008 0.004 0.008
平衡量(mol/L) 0.002 0.001 0.008
K=
| 0.0082 |
| 0.0022×0.001 |
反应的平衡常数K(700℃)>K(800℃),温度升高平衡常数减小,平衡逆向进行,逆向是吸热反应,正反应是放热反应,
故答案为:16000L?mol-1;放;
②0~2s内该反应的平均速率v(O2)=
| 1 |
| 2 |
| 1 |
| 2 |
| 0.01mol/L-0.003mol/L |
| 2s |
下列能说明该反应已经达到平衡状态的判断依据,反应达到平衡的标志是正逆反应速率相同,个组成含量不变,分析“变量不变”来判断选项;
a.速率之比等于化学方程式系数之比,v(NO2)=2v(O2)表示的是正反应速率之比,不能说明反应达到平衡,故a错误;
b.反应前后是气体体积变化的反应,容器内压强保持不变,说明反应达到平衡状态,故b正确;
c.速率之比等于化学方程式系数之比,v(NO2)=2v(O2)表示的是正反应速率之比,v逆(NO)=2v正(O2),说明一氧化氮的正逆反应速率相同,反应达到平衡状态,故c正确;
d.反应前后气体质量不变,容器体积不变,密度始终不变,容器内的密度保持不变不能说明反应达到平衡状态,故d错误;
故答案为:1.75×10-3mol?L-1?s-1;bc;
③为使该反应的反应速率增大,且平衡向正反应方向移动的;
a.及时分离出NO2气体,平衡正向进行,但反应速率减小,故a不符合;
b.反应是放热反应,适当升高温度,速率增大,但平衡逆向进行,故b不符合;
c.增大O2的浓度平衡正向进行,反应速率增大,故c符合;
d.选择高效的催化剂只能改变反应速率不能改变平衡,故d不符合;
故答案为:c;
(2)①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ?mol-1
由盖斯定律计算②×2-①得到气态肼和NO2生成氮气和水蒸气的热化学方程式:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1153.7kJ?mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1153.7kJ?mol-1;
(3)N2H4+O2=N2+2H2O,强碱溶液中发生的原电池反应中,燃料在负极失电子发生氧化反应,该燃料电池的负极电极反应式是N2H4+4OH--4e-=N2+4H2O,
故答案为:N2H4+4OH--4e-=N2+4H2O.
点评:本题考查了化学平衡常数计算,平衡影响因素分析判断,平衡标志的理解应用,反应速率平衡常数计算、原电池原理的分析应用、盖斯定律计算是解题关键,题目难度中等.

练习册系列答案
相关题目
 A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000mL,其pH的变化如图所示,则下列判断正确的是( )
A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000mL,其pH的变化如图所示,则下列判断正确的是( )| A、原酸溶液的浓度c(A)=c(B) |
| B、原酸溶液的浓度c(A)>c(B) |
| C、若a=5,则A为强酸,B为弱酸 |
| D、若2<a<5,则A、B都是弱酸,酸性A<B |
下列离子方程式不正确的是( )
| A、将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| B、用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| C、醋酸钠的水解:CH3COO-+H3O+?CH3COOH+H2O |
D、苯酚钠溶液中通入CO2气体: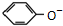 +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
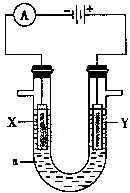 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.