题目内容
5.在硫酸钠和硫酸钾的混合溶液中,当n(Na+)=0.2mol,n(SO42-)=x mol,n(K+)=ymol时,则的关系是)( )| A. | x=$\frac{y}{2}$ | B. | x=0.1+$\frac{y}{2}$ | C. | y=2(x+0.1) | D. | y=2x+0.1 |
分析 根据溶液中阴阳离子所带的正负电荷总数相等,则有c(Na+)+c(K+)=2c(SO42-),据此计算
解答 解:根据溶液中阴阳离子所带的正负电荷总数相等,则有c(Na+)+c(K+)=2c(SO42-),在硫酸钠和硫酸钾的混和溶液中,体积相同,假设体积为1升,即:
0.2mol/L×1+ymol/L×1=xmol/L×2,解得:x=0.1+$\frac{y}{2}$,
故选B.
点评 本题主要考查溶液物质的量的计算,题目难度不大,注意电荷守恒原则在混合溶液有关离子浓度计算运用,侧重于学生的分析能力和计算能力的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列鉴别方法不可行的是( )
| A. | 用水鉴别乙醇和溴苯 | |
| B. | 用红外光谱鉴别丙醛和1-丙醇 | |
| C. | 用溴水鉴别苯和正庚烷 | |
| D. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
16.下列叙述正确的是( )
| A. | 硫离子的结构示意图为 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 氢弹中用到的2H、3H互为同位素 | |
| D. | 同种元素的原子均有相同的质子数和中子数 |
13.下列有关物质的分类正确的是( )
| A. | 氯化钡、四氯化碳、硫酸、碘酒都属于化合物 | |
| B. | 硝酸、纯碱、磷酸钠、二氧化碳分别属于酸、碱、盐、氧化物 | |
| C. | 溶液、浊液、胶体、空气都属于混合物 | |
| D. | CO2、SO2、P2O5、CO都属于酸性氧化物 |
8. 碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
(1)已知:
2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H2=-566kJ/mol
请写出CH4燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)在不同温度下反应CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数K如表:
①该反应的△H<0.(填“>”、“=”或“<”).
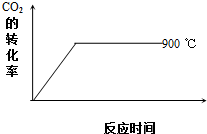
②900℃时发生上述反应,CO2的转化率随时间变化如图所示,若到达平衡后加压,则H2的转化率将(填“增大”、“减小”或“不变”,下同)不变,正反应速率将增大.其他条件相同时,请在图中画出750℃时CO2的转化率随时间变化的示意图.
③在900℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是(填编号)AD,平衡后与C中各物质的百分含量相等的组有BD(填编号)
(3)以二甲醚(CH3OCH3)、空气、KOH溶液为原料可设计为燃料电池
①放电时,负极电极反应式:CH3OCH3-12e-+16OH-=2CO32-+11H2O.
②假设该燃料电池中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为6.72L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
 碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:(1)已知:
2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H2=-566kJ/mol
请写出CH4燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)在不同温度下反应CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数K如表:
| 温度/℃ | 600 | 750 | 900 | 1100 | 1250 |
| 平衡常数K | 2.5 | 1.6 | 1 | 0.9 | 0.6 |
②900℃时发生上述反应,CO2的转化率随时间变化如图所示,若到达平衡后加压,则H2的转化率将(填“增大”、“减小”或“不变”,下同)不变,正反应速率将增大.其他条件相同时,请在图中画出750℃时CO2的转化率随时间变化的示意图.
③在900℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是(填编号)AD,平衡后与C中各物质的百分含量相等的组有BD(填编号)
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
①放电时,负极电极反应式:CH3OCH3-12e-+16OH-=2CO32-+11H2O.
②假设该燃料电池中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为6.72L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题: