题目内容
17.在恒温恒压下,向密闭容器中充入4mol SO2和2mol O2混合气体,2min后,反应达到平衡,生成SO3气体0.5mol,同时放出热量Q kJ.回答下列问题(1)该写出反应的热化学方程式为2SO2(g)+O2(g)?2SO3(g)△H=-4QkJ•mol-1.
(2)在该条件下,反应前后容器的体积之比为6:5.75.
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)小于0.5mol(填“大于”、“小于”或“等于”);
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量小于Q kJ(填“大于”、“小于”或“等于”).
分析 (1)根据生成SO3气体0.5mol,同时放出热量Q kJ,计算生成2mol时放出的热量,写热化学方程式,注意标物质状态;
(2)通过三段式计算平衡时各物质的量,恒压下,气体的体积之比=物质的量之比;
(3)①该反应是放热反应,绝热条件下,反应器温度升高,相对于恒温平衡逆向移动;
②该反应气体体积减小,恒容条件相当于对恒压条件平衡下的减小压强,平衡逆向移动,放出的热量减小.
解答 解:(1)生成SO3气体0.5mol,同时放出热量Q kJ,则生成2mol SO3时放出的热量为4Q,则热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-4Q kJ•mol-1;
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-4Q kJ•mol-1;
(2)反应2SO2(g)+O2(g)?2SO3(g)
起始量(mol):4 2 0
转化量(mol):0.5 0.25 0.5
平衡量(mol):3.5 1.75 0.5
则反应前后容器的体积之比为:(4+2):(3.5+1.75+0.5)=6:5.75;
故答案为:6:5.75;
(3)①该反应是放热反应,绝热条件下,反应器温度升高,相对于恒温平衡逆向移动,平衡后n(SO3)小于0.5mol;
故答案为:小于;
②该反应气体体积减小,恒容条件相当于对恒压条件平衡下的减小压强,平衡逆向移动,吸收热量,则放出的热量小于Q;
故答案为:小于.
点评 本题考查了化学平衡计算应用和外界条件对化学平衡的影响,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
7.下列叙述正确的是( )
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | NaCl只有在水溶液中才能电离出Na+、Cl- | |
| C. | 能与酸反应的氧化物,不一定是碱性氧化物 | |
| D. | 电离时能产生H+的化合物是酸 |
5.在硫酸钠和硫酸钾的混合溶液中,当n(Na+)=0.2mol,n(SO42-)=x mol,n(K+)=ymol时,则的关系是)( )
| A. | x=$\frac{y}{2}$ | B. | x=0.1+$\frac{y}{2}$ | C. | y=2(x+0.1) | D. | y=2x+0.1 |
12.下列物质的水溶液能导电,且属于强电解质的是( )
| A. | NH4HCO3 | B. | Cl2 | C. | CH3COOH | D. | SO2 |
2.下面是溶解性表中的部分内容(室温下测定):
下列有关说法中正确的是( )
| 阳离子 | 阴离子 | ||
| OH- | SO42- | SO32- | |
| Ca2+ | ① | 微 | 不 |
| Fe3+ | 不 | 溶 | ② |
| Cu2+ | 不 | ③ | 不 |
| A. | ①处物质属于可溶性碱 | |
| B. | ②处物质组成为Fe2(SO3)3 | |
| C. | ③处物质为硫酸盐或者铜盐 | |
| D. | ①、③处物质在溶液中发生的反应一定是Cu2++2OH-═Cu(OH)2↓ |
20.有关溶度积Ksp的说法正确的是( )
| A. | Ksp的数值只与温度有关 | |
| B. | Ksp的数值只与难溶电解质的性质和温度有关 | |
| C. | Ksp的大小与沉淀量有多少和溶液中离子浓度的大小有关 | |
| D. | Ksp的数值越大,电解质在水中的溶解能力越强 |
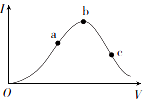 一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.
一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.