题目内容
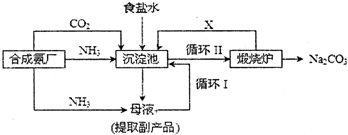
7.侯氏制碱又称氨碱法,其主要生产流程如图1: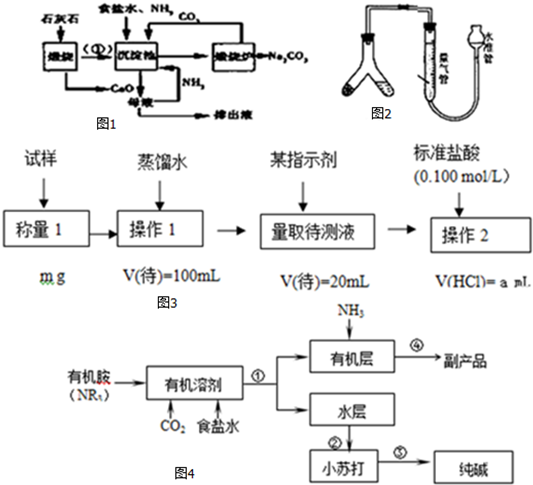
(1)用化学方程式表示沉淀池中发生的反应NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,排出液的主要成分是CaCl2.氨碱法制得的纯碱样品中可能会含有杂质(如NaCl).现用两个实验方案测定纯碱样品的纯度.
方案1气体法:称取样品m克装入Y型试管左侧(如图2)
(2)Y型试管另一端应装入试剂为稀硫酸,量气管中液体应为饱和NaHCO3.若最后读数时,发现水准管液面高于量气管(其他操作都正确),则计算所得纯碱样品的纯度值偏小 (填“偏大”、“偏小”或“无影响”).
方案2滴定法如图3:
已知:25℃时0.1mol/L的NaHCO3溶液的pH约为8.3
0.1mol/L的Na2CO3溶液的pH约为11.6
(3)指示剂选用酚酞,则该纯碱样品的纯度为$\frac{0.053a}{m}$或$\frac{5.3a}{m}$%.(请用所给数据的字母符号表示)氨碱法中钠利用率不高,一些化工专家开始研究有机胺制碱法,其工艺流程如图4:
已知:NR3+HCl→NR3•HCl,且NR3•HCl易溶于有机溶剂
NR3•HCl+NH3→NR3+NH4Cl
(4)有机胺制碱法反应生成小苏打的化学方程式是NaCl+NR3+CO2+H2O=NaHCO3↓+NR3•HCl,操作①是(萃取)分液.
(5)副产品的成分是NH4Cl,本工艺流程中可循环利用的物质是有机溶剂、NR3、CO2.
分析 (1)沉淀池中生成NaHCO3,由氨气、氯化钠、二氧化碳反应生成;反应后母液中含有氯化铵,加入CaO,可生成氨气和氯化钙;
(2)用气体法测定纯碱的含量,可用稀硫酸和样品反应生成二氧化碳,用排饱和碳酸氢钠溶液的方法测定体积;
(3)以酚酞为指示剂,滴定终点生成NaHCO3,发生Na2CO3+HCl=NaCl+NaHCO3,以此计算;
(4)由反应流程可知有机胺、二氧化碳、氨气在有机层中反应生成碳酸氢钠和氯化铵,有机层和水溶液分层;
(5)有机层中通入氨气,发生NR3•HCl+NH3→NR3+NH4Cl,结合反应物和生成物判断循环使用的物质.
解答 解:(1)沉淀池中生成NaHCO3,由氨气、氯化钠、二氧化碳反应生成,反应的化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,反应后母液中含有氯化铵,加入CaO,可生成氨气和氯化钙,排出液含有氯化钙,氨气可循环使用,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl; CaCl2;
(2)用气体法测定纯碱的含量,可用稀硫酸和样品反应生成二氧化碳,用排饱和碳酸氢钠溶液的方法测定体积,则Y型试管另一端应装入试剂为稀硫酸,量气管中液体应为饱和NaHCO3,若最后读数时,发现水准管液面高于量气管,则气体压强偏大,体积偏小,测量的体积偏小,含量偏小,
故答案为:稀硫酸;饱和NaHCO3;偏小;
(3)以酚酞为指示剂,滴定终点生成NaHCO3,发生Na2CO3+HCl=NaCl+NaHCO3,则样品中n(Na2CO3)=5n(HCl)=5×0.1mol/L×a×10-3L=5a×10-4mol,质量为5.3a×10-2g,样品质量为mg,则含量为$\frac{0.053a}{m}$ 或$\frac{5.3a}{m}$%,
故答案为:$\frac{0.053a}{m}$ 或$\frac{5.3a}{m}$%;
(4)由反应流程可知有机胺、二氧化碳、氨气在有机层中反应生成碳酸氢钠和氯化铵,反应的化学方程式为NaCl+NR3+CO2+H2O=NaHCO3↓+NR3•HCl,有机层和水溶液分层,可用(萃取)分液的方法分离,
故答案为:NaCl+NR3+CO2+H2O=NaHCO3↓+NR3•HCl;(萃取)分液;
(5)有机层中通入氨气,发生NR3•HCl+NH3→NR3+NH4Cl,副产品为NH4Cl,由反应所用原料可知有机溶剂、NR3、CO2可用于循环使用,
故答案为:NH4Cl;有机溶剂、NR3、CO2.
点评 本题综合考查物质的制备以及含量的测定,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验的原理和题给信息的判断,难度不大.

| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成分的药量 | 0.245g | 0.5g |
| A. | x=$\frac{y}{2}$ | B. | x=0.1+$\frac{y}{2}$ | C. | y=2(x+0.1) | D. | y=2x+0.1 |
| 阳离子 | 阴离子 | ||
| OH- | SO42- | SO32- | |
| Ca2+ | ① | 微 | 不 |
| Fe3+ | 不 | 溶 | ② |
| Cu2+ | 不 | ③ | 不 |
| A. | ①处物质属于可溶性碱 | |
| B. | ②处物质组成为Fe2(SO3)3 | |
| C. | ③处物质为硫酸盐或者铜盐 | |
| D. | ①、③处物质在溶液中发生的反应一定是Cu2++2OH-═Cu(OH)2↓ |
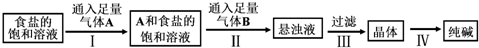
| A. | 气体A是NH3,气体B是CO2 | |
| B. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| C. | 第III步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 | |
| D. | 第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
| A. | 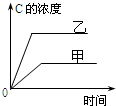 研究的是温度对反应的影响,且乙的温度较高 | |
| B. | 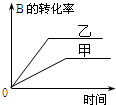 研究的是压强对反应的影响,且甲的压强较高 | |
| C. | 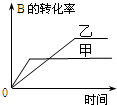 研究的是温度对反应的影响,且乙的温度较高 | |
| D. | 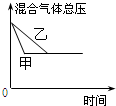 研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
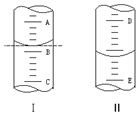 ①如图Ⅰ表示10mL量筒中液面的位置.A与B,B与C刻度间相差1mL,如果刻度A为6,量筒中液体的体积是5.2 mL.
①如图Ⅰ表示10mL量筒中液面的位置.A与B,B与C刻度间相差1mL,如果刻度A为6,量筒中液体的体积是5.2 mL.