题目内容
16.下列叙述正确的是( )| A. | 硫离子的结构示意图为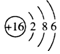 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 氢弹中用到的2H、3H互为同位素 | |
| D. | 同种元素的原子均有相同的质子数和中子数 |
分析 A、硫离子是硫原子得到两个电子形成的;
B、核外电子排布相同的微粒不一定属于同一种元素;
C、同种元素的不同种原子间互为同位素;
D、同种元素的不同种原子具有相同的质子数.
解答 解:A、硫离子是硫原子得到两个电子形成的,故核外有18个电子,结构示意图为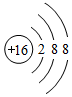 ,故A错误;
,故A错误;
B、核外电子排布相同的微粒不一定属于同一种元素,如钠离子和镁离子的核外电子排布相同,但化学性质不同,故B错误,
C、同种元素的不同种原子间互为同位素,2H、3H同是氢元素的两种氢原子,故互为同位素,故C正确;
D、同种元素的不同种原子具有相同的质子数,但中子数不同,故D错误.
故选C.
点评 本题考查和离子结构示意图和同位素的概念等,难度不大,应注意的是同位素的化学性质相同,但具有相同电子数的微粒的化学性质不一定相同.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
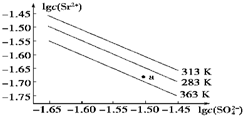

| A. | 温度一定时,Ksp(SrSO4)随c(SO42- )的增大而减小 | |
| B. | 三个不同温度中,313 K时Ksp(SrSO4)最大 | |
| C. | 283 K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
7.下列叙述正确的是( )
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | NaCl只有在水溶液中才能电离出Na+、Cl- | |
| C. | 能与酸反应的氧化物,不一定是碱性氧化物 | |
| D. | 电离时能产生H+的化合物是酸 |
4.下列是常用的中和胃酸的药物:
估算10片胃舒平和5片达喜,含铝的物质的量较多的是10片胃舒平.
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成分的药量 | 0.245g | 0.5g |
1.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同)CDE.
A、生成CH3OH的速率与消耗CO的速率相等
B、混合气体的密度不变
C、混合气体的平均相对分子质量不变
D、CH3OH、CO、H2的浓度都不再发生变化
E、容器中气体的压强不再改变
(2)表所列数据是反应在不同温度下的化学平衡常数(K).
①写出该反应的平衡常数K的表达式K=$\frac{c(C{H}_{3}OH)}{c(CO).{c}^{2}({H}_{2})}$
②由表中数据判断该反应的△H<0(填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,5min时达到平衡,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃,在0~5min内,以H2表示的平均反应速率为0.32mol•L-1•min-1,平衡时CH3OH的浓度为0.8mol•L-1•
(1)判断反应达到平衡状态的依据是(填字母序号,下同)CDE.
A、生成CH3OH的速率与消耗CO的速率相等
B、混合气体的密度不变
C、混合气体的平均相对分子质量不变
D、CH3OH、CO、H2的浓度都不再发生变化
E、容器中气体的压强不再改变
(2)表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②由表中数据判断该反应的△H<0(填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,5min时达到平衡,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃,在0~5min内,以H2表示的平均反应速率为0.32mol•L-1•min-1,平衡时CH3OH的浓度为0.8mol•L-1•
5.在硫酸钠和硫酸钾的混合溶液中,当n(Na+)=0.2mol,n(SO42-)=x mol,n(K+)=ymol时,则的关系是)( )
| A. | x=$\frac{y}{2}$ | B. | x=0.1+$\frac{y}{2}$ | C. | y=2(x+0.1) | D. | y=2x+0.1 |
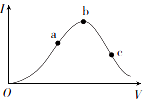 一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.
一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.