题目内容
2.新型固体LiFePO4隔膜电池广泛应用于电动汽车,可减缓大气污染.电池反应为FePO4+Li$?_{充电}^{放电}$LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电.该电池放电时Li+向 极移动正(填“正”或“负”),正极反应式为FePO4+Li++e-=LiFePO4.分析 原电池中阳离子移向正极;依据总反应方程式和负极电极反应计算得到正极电极反应式.
解答 解:FePO4+Li?LiFePO4 放电过程是原电池,锂离子带正电荷,向着原电池的正极移动;负极反应为Li-e-═Li+,总反应方程式减去负极反应得到正极电极反应:FePO4+Li++e-=LiFePO4,
故答案为:正;FePO4+Li++e-=LiFePO4.
点评 本题考查了原电池原理的应用,题目难度中等,注意把握原电池中正负极的判断以及电极方程式的书写方法、溶液中离子的移动方向,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
12.下列化学用语表示正确的是( )
| A. | 乙酸的结构简式:C2H4O2 | |
| B. | 乙烯的电子式: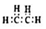 | |
| C. | 硫离子结构示意图: | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH-)2 |
13.下列有关物质的性质与用途不对应的是( )
| A. | 铝合金的密度小,硬度大,可用作建筑材料 | |
| B. | 食品工业用Na2CO3作焙制糕点的膨松剂 | |
| C. | FeCl3溶液能与Cu反应,可用于腐蚀铜制印刷电路板 | |
| D. | 明矾能生成Al(OH)3胶体,可用作净水剂 |
17.水解反应与社会、生活密切相关.对下列现象、事实或解释不正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 泡沫灭火器(含有NaHCO3与硫酸铝)灭火 | 3HCO3-+Al3+=Al(OH)3↓+3CO2↑ |
| B | 将AlCl3溶液加热、蒸干、灼烧,可的导固体Al2O3 | 加热促进了AlCl水解 |
| C | 施肥时,草木灰(有效成分为K2CO3)与NH4Cl混合使用 | 同时使用氮肥和钾肥效果更好 |
| D | 配制SnCl2溶液时,先用盐酸酸化蒸馏水,然后加入SnCl2晶体 | 盐酸抑制SnCl2水解 |
| A. | A | B. | B | C. | C | D. | D |
6.下列离子方程式正确的是( )
| A. | Fe3O4溶于足量稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | 4mol/LNaAlO2溶液与7mol/L盐酸等体积混合:4AlO2-+7H++H2O=3Al(OH)3↓+A13+ | |
| C. | K37ClO3与浓盐酸在加热条件下生成氯气:37ClO3-+6Cl-+6H+=37Cl-+3Cl2↑+3H2O | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++NH3↑+Ag+H2O |

 某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.


