题目内容
11.0.2mol有机物和0.4molO2在密闭容器中燃烧后的产物为CO2、CO和H2O(g).产物经过碱石灰后,碱石灰质量增加19.6g;再通过足量灼热CuO充分反应后,固体质量减轻3.2g.(1)计算求出该有机物的摩尔质量.(写出解题过程)
(2)已知:有机物中同一个碳原子上连两个烃基是不稳定的,若将燃烧产物通入澄清石灰水中产生20g沉淀,该0.2mol有机物恰好能与9.2g钠完全反应,试确定该有机物的结构简式.
分析 (1)通过碱石灰时,碱石灰的质量增加了19.6g为水和CO2的质量;通过灼热氧化铜,由于发生反应CuO+CO$\frac{\underline{\;△\;}}{\;}$Cu+CO2,固体质量减轻了3.2g,结合方程式利用差量法可计算CO的物质的量和质量,根据质量守恒可知有机物的质量,进而求得摩尔质量;
(2)根据质量守恒定律求出有机物的分子式,结合分子式、与钠反应生成氢气的体积,判断分子中官能团,据此书写结构简式.
解答 解:(1)通过碱石灰时,碱石灰的质量增加了19.6g为水和CO2的质量;通过灼热氧化铜,由于发生反应CuO+CO$\frac{\underline{\;△\;}}{\;}$Cu+CO2,固体质量减轻了3.2g,
设有机物燃烧生成的CO为x,则:
CuO+CO$\frac{\underline{\;△\;}}{\;}$Cu+CO2,固体减少△m
28g 16g
x 3.2g
所以x=$\frac{28g×3.2g}{16g}$=5.6g,CO的物质的量为$\frac{5.6g}{28g/mol}$=0.2mol,故CO的质量为0.2mol×28g/mol=5.6g;
设有机物的质量为xg,由于0.4mol氧气的质量为12.8g,则根据质量守恒有:xg+12.8g=5.6g+19.6g
解得x=12.4g
故此有机物的摩尔质量M=$\frac{m}{n}$=$\frac{12.4g}{0.2mol}$=62g/mol.
答:此有机物的摩尔质量为62g/mol.
(2)由于将燃烧产物通入澄清石灰水中产生20g沉淀,即0.2molCaCO3,则可知燃烧生成的CO2的物质的量为0.2mol,质量为8.8g,而碱石灰的质量增加了19.6g为水和CO2的质量和,故燃烧生成的水的质量为19.6g-8.8g=10.8g,物质的量为n=$\frac{10.8g}{18g/mol}$=0.6mol,设有机物的分子式为CxHyOz,则此有机物燃烧的情况为:
0.2molCxHyOz+0.4molO2$\stackrel{点燃}{→}$0.2molCO+0.2molCO2+0.6molH2O.
根据碳原子个数守恒可知:0.2x=0.2+0.2,解得x=2;
根据氢原子个数守恒可知:0.2y=0.6×2,解得y=6;
根据氧原子个数守恒可知:0.2z+0.4×2=0.2+0.4+0.6,解得z=2.
故此有机物的分子式为C2H6O2.
由于9.2g金属钠的物质的量为$\frac{9,2g}{23g/mol}$=0.4mol,与0.2mol该有机物恰好完全反应,故该有机物分子中含有2个羟基,该有机物的结构简式为HOCH2CH2OH,
答:该有机物的结构简式为HOCH2-CH2OH.
点评 本题考查利用燃烧法确定有机物分子式、有机物结构的判断、官能团的性质等,题目难度中等,注意掌握原子守恒判断有机物的分子式方法.

| A. | 2-甲基丁烷也称异丁烷 | B. | 由乙烯生成乙醇属于加成反应 | ||
| C. | C4H9Cl有3种同分异构体 | D. | 油脂和蛋白质都属于高分子化合物 |
| A. | 向0.1mol•L-1 CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 将CH3COONa溶液从20℃升温至30℃,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| C. | 向盐酸中加入氨水至中性,溶液中$\frac{c(N{{H}_{4}}^{+})}{c(C{l}^{-})}$>1 | |
| D. | 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中$\frac{c(C{l}^{-})}{c(B{r}^{-})}$不变 |
| A. | AlCl3 | B. | KOH | C. | HCl | D. | H2O |
| A. | 溶液变红 | B. | 铜币表面变色 | C. | 溶液颜色不变 | D. | 有大量气泡冒出 |
| A. | 氯化氢分子的电子式: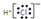 | B. | S2-的结构示意图: | ||
| C. | 四氯化碳的电子式: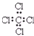 | D. | N2分子的结构式:N=N |