题目内容
4.某烃的蒸气密度是H2密度36倍,现有8.648g该烃充分燃烧,产物依次通过足量浓硫酸和澄清石灰水溶液,浓硫酸增重12.96g,澄清石灰水溶液中产生60g白色沉淀,通过计算确定:(1)该烃的分子式;
(2)写出该烃所有结构简式.
分析 某烃的蒸气密度是H2密度36倍,则相对分子质量为72,烃的物质的量为$\frac{8.648g}{72g/mol}$=0.12mol,8.648g该烃充分燃烧,产物依次通过足量浓硫酸和澄清石灰水溶液,浓硫酸增重12.96g,为水的质量,则n(H2O)=$\frac{12.96g}{18g/mol}$=0.72mol,则n(H)=1.44mol,澄清石灰水溶液中产生60g白色沉淀,为碳酸钙的质量,则n(CaCO3)=$\frac{60g}{100g/mol}$=0.6mol,则n(C)=0.6mol,由此可计算1mol有机物中含有C、H的物质的量,进而确定分子式和可能的结构简式.
解答 解:(1)某烃的蒸气密度是H2密度36倍,则相对分子质量为72,烃的物质的量为$\frac{8.648g}{72g/mol}$=0.12mol,8.648g该烃充分燃烧,产物依次通过足量浓硫酸和澄清石灰水溶液,浓硫酸增重12.96g,为水的质量,则n(H2O)=$\frac{12.96g}{18g/mol}$=0.72mol,则n(H)=1.44mol,澄清石灰水溶液中产生60g白色沉淀,为碳酸钙的质量,则n(CaCO3)=$\frac{60g}{100g/mol}$=0.6mol,则n(C)=0.6mol,
所以有机物中C原子个数为$\frac{0.6mol}{0.12mol}$=5,
H原子个数为$\frac{1.44mol}{0.12mol}$=12,
应为C5H12,
答:该烃的分子式为C5H12;
(2)C5H12的同分异构体有CH3-CH2-CH2-CH2-CH3; ;
; ,
,
答:该烃所有结构简式分别为CH3-CH2-CH2-CH2-CH3、 、
、 .
.
点评 本题考查有机物分子式的确定、同分异构体书写等,侧重于学生的分析、计算能力的考查,比较基础,注意掌握燃烧法根据原子守恒确定有机物分子式.

| A. | 抗氧化剂 | B. | 调味剂 | C. | 着色剂 | D. | 增稠剂 |
| A. | 2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L CO2气体中含有的氧原子数为0.5NA | |
| C. | 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA | |
| D. | 0.1L0.5mol/L CH3COOH溶液中含有的H+数为0.05NA |
| A. | 羽毛球拍属于复合材料 | B. | 包装纸箱属于无机材料 | ||
| C. | 塑料笔杆属于高分子材料 | D. | 生肖纪念币属于合金材料 |
分别取少量上述溶液于4支试管中,然后分别加入Ba(OH)2溶液并加热,用湿润的红色石蕊试纸在试管口检验.上述操作不能鉴别出来的物质是KCl、NaCl.对于可以鉴别的物质,请填写表(可不填满):
| 可以鉴别的物质 | 实验现象 | 有关反应的化学方程式 |
| . |
| A | B | C | D |
 |  | 饱和NaHSO3溶液 |  |
| 制乙炔的发生装置 | 蒸馏时的接收装置 | 除去SO2中的少量HCl | 准确量取一定体积K2Cr2O7标准溶液 |
| A. | A | B. | B | C. | C | D. | D |
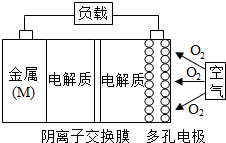 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )| A. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面 | |
| B. | 比较Mg,Al,Zn三种金属-空气电池,Al-空气电池的理论比能量最高 | |
| C. | M-空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne-=4M(OH)n | |
| D. | 在Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 |
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | 原子核外各电子层容纳的电子数为2n2个 | |
| C. | 核外电子的分层排布就是核外电子的分层运动 | |
| D. | ⅥA族元素的原子,其半径越大,越容易得电子 |