题目内容
已知R有多种化合价,其最高正价为+7价.在一定条件下,RO
与R-可发生反应:RO
+5R-+6H+=3R2+3H2O,下列关于R元素的叙述中,正确的是( )
- 3 |
- 3 |
| A、元素R位于周期表中第VA族 | ||
B、RO
| ||
| C、R-离子的最外层电子数为8 | ||
D、若1molRO
|
考点:氧化还原反应
专题:氧化还原反应专题
分析:RO3-+5R-+6H+=3R2+3H2O中,R元素的化合价由+5价降低为0,由-1价升高为0,R元素的最高价为+7价,以此来解答.
解答:
解:A.由R-可知,R元素的最高价为+7价,则R位于周期表中第VⅡA族,故A错误;
B.RO3-中,R为+5价,既能失去电子也可得到电子,则可被氧化也可被还原,故B错误;
C.R-可知,R元素的最高价为+7价,R-离子的最外层电子数为8,故C正确;
D.若1molRO3-参与该反应,则转移的电子的物质的量为1ml×(5-0)=5mol,故D正确;
故选CD.
B.RO3-中,R为+5价,既能失去电子也可得到电子,则可被氧化也可被还原,故B错误;
C.R-可知,R元素的最高价为+7价,R-离子的最外层电子数为8,故C正确;
D.若1molRO3-参与该反应,则转移的电子的物质的量为1ml×(5-0)=5mol,故D正确;
故选CD.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从元素的化合价角度分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
一种以2mol?L Na2SO4水溶液为电解质的钠离子电池的总反应如下:NaTi2(PO4)3+Zn+Na2SO4
Na3Ti2(PO4)3+ZnSO4其中P的化合价为+5,下列有关说法正确的是( )
| 放电 |
| 充电 |
| A、放电时,NaTi2(PO4)3发生氧化反应 |
| B、放电时,钠离子向负极移动 |
| C、充电时,阳极反应式为:Zn-2e-=Zn2+ |
| D、充电时,每移动0.2mol电子,消耗0.1mol Na3Ti2(PO4)3 |
下列叙述正确的是( )
| A、某元素由化合态变成游离态,该元素一定被氧化 |
| B、卤素离子(X-)只有还原性而无氧化性 |
| C、失电子难的原子获得电子的能力一定强 |
| D、负一价卤素离子的还原性在同一族中从上至下逐渐增强 |
下列反应的离子方程式正确的是( )
| A、金属钠跟水反应2Na+2H2O═2Na++2OH-+H2↑ |
| B、氨气通入醋酸溶液NH3+H+═NH4+ |
| C、铜与稀硝酸反应Cu+2NO3-+2H+=Cu2++NO2↑+H2O |
| D、碳酸钙溶于盐酸Ca2++2H+═Ca2++H2O+CO2↑ |
 反应2X(g)+Y(g)?2Z△H<0 在不同温度和压强下,产物Z的物质的量与反应时间的关系如图所示.则下列叙述正确的是( )
反应2X(g)+Y(g)?2Z△H<0 在不同温度和压强下,产物Z的物质的量与反应时间的关系如图所示.则下列叙述正确的是( )| A、T1>T2,P1<P2 |
| B、T1>T2,P1>P2 |
| C、T1<T2,P1>P2 |
| D、T1<T2,P1<P2 |
设阿伏加德常数为NA,下列说法正确的是( )
| A、常温下,5.6g铁与足量的稀盐酸反应失去的电子数为0.3NA |
| B、11.2L CO2与8.5g NH3所含的分子数相等 |
| C、2g Na2O溶于水后,所得溶液中O2-个数为0.1NA |
| D、100mL 1mol?L-1 Na2SO4溶液中含Na+个数为0.2NA |
下列化学反应方程式或离子方程式书写正确的是( )
| A、乙烯制溴乙烷:CH2CH2+Br2→CH2BrCH2Br | |||
B、乙醇催化氧化:2CH3CH2OH+O2
| |||
C、苯与氢气加成: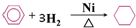 | |||
| D、从海带中提取碘:H2O2+2I-+2H+=I2+2H2O |
 以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题: 某化学兴趣小组的同学用如图装置研究电化学的问题.
某化学兴趣小组的同学用如图装置研究电化学的问题.