题目内容
一种以2mol?L Na2SO4水溶液为电解质的钠离子电池的总反应如下:NaTi2(PO4)3+Zn+Na2SO4
Na3Ti2(PO4)3+ZnSO4其中P的化合价为+5,下列有关说法正确的是( )
| 放电 |
| 充电 |
| A、放电时,NaTi2(PO4)3发生氧化反应 |
| B、放电时,钠离子向负极移动 |
| C、充电时,阳极反应式为:Zn-2e-=Zn2+ |
| D、充电时,每移动0.2mol电子,消耗0.1mol Na3Ti2(PO4)3 |
考点:化学电源新型电池
专题:电化学专题
分析:A、化合价降低元素所在的反应物是氧化剂,发生还原反应;
B、原电池中,电解质里的阳离子移向正极,阴离子移向负极;
C、电解池的阳极上发生失电子的氧化反应;
D、根据电极方程式结合电子转移来回答计算.
B、原电池中,电解质里的阳离子移向正极,阴离子移向负极;
C、电解池的阳极上发生失电子的氧化反应;
D、根据电极方程式结合电子转移来回答计算.
解答:
解:A、放电时,化合价降低的Ti元素所在的反应物NaTi2(PO4)3发生还原反应,故A错误;
B、原电池中,电解质里的阳离子移向正极,阴离子移向负极,所以钠离子移向正极,故B错误;
C、充电时,阳极上发生失电子的氧化反应:Ti2(PO4)33--2e-=Ti2(PO4)3-,故C错误;
D、根据电池反应:NaTi2(PO4)3+Zn+Na2SO4
Na3Ti2(PO4)3+ZnSO4,转移电子是2mol,即每移动2mol电子,消耗1mol Na3Ti2(PO4)3,所以每移动0.2mol电子,消耗0.1mol Na3Ti2(PO4)3,故D正确.
故选D.
B、原电池中,电解质里的阳离子移向正极,阴离子移向负极,所以钠离子移向正极,故B错误;
C、充电时,阳极上发生失电子的氧化反应:Ti2(PO4)33--2e-=Ti2(PO4)3-,故C错误;
D、根据电池反应:NaTi2(PO4)3+Zn+Na2SO4
| 放电 |
| 充电 |
故选D.
点评:本题考查学生二次电池的工作原理知识,实际上是考查学生原电池和电解池的工作原理,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
相关题目
隆冬季节,雾霾天气增多造成一些城市空气重度污染,其中的污染物不包括( )
| A、PM2.5 |
| B、NO2 |
| C、SO2 |
| D、CO2 |
下列说法正确的是( )
A、
| ||
B、 互为同分异构体 互为同分异构体 | ||
| C、正丁烷与异丁烷互为同系物 | ||
| D、32S与33S是同种核素 |
如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
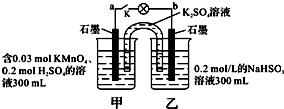

| A、当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1 |
| B、电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a |
| C、电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 |
| D、乙池中的氧化产物为SO42- |
下列有关原电池的说法中正确的是( )
| A、电极一定要由两种不同的金属组成 |
| B、电子流出的一极是正极 |
| C、两极均发生氧化还原反应 |
| D、由化学能转化为电能的装置 |
已知R有多种化合价,其最高正价为+7价.在一定条件下,RO
与R-可发生反应:RO
+5R-+6H+=3R2+3H2O,下列关于R元素的叙述中,正确的是( )
- 3 |
- 3 |
| A、元素R位于周期表中第VA族 | ||
B、RO
| ||
| C、R-离子的最外层电子数为8 | ||
D、若1molRO
|
 卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近.试回答下列问题:
卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近.试回答下列问题: