题目内容
下列叙述正确的是( )
| A、某元素由化合态变成游离态,该元素一定被氧化 |
| B、卤素离子(X-)只有还原性而无氧化性 |
| C、失电子难的原子获得电子的能力一定强 |
| D、负一价卤素离子的还原性在同一族中从上至下逐渐增强 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:A.某元素由化合态变成游离态,可能被氧化也可能被还原;
B.卤素离子元素化合价最低,只能被氧化;
C.失电子难的物质,得电子能力不一定强;
D.元素的非金属性越强,对应的阴离子的还原性越弱.
B.卤素离子元素化合价最低,只能被氧化;
C.失电子难的物质,得电子能力不一定强;
D.元素的非金属性越强,对应的阴离子的还原性越弱.
解答:
解:A.某元素由化合态变成游离态,可能被氧化也可能被还原,如S2-→S为被氧化的过程,而Fe2+→Fe为被还原的过程,故A错误;
B.卤素离子元素化合价最低,只能被氧化,只具有还原性,故B正确;
C.失电子难的物质,得电子能力不一定强,如惰性气体元素,故C错误;
D.元素的非金属性越强,对应的阴离子的还原性越弱,故D正确.
故选BD.
B.卤素离子元素化合价最低,只能被氧化,只具有还原性,故B正确;
C.失电子难的物质,得电子能力不一定强,如惰性气体元素,故C错误;
D.元素的非金属性越强,对应的阴离子的还原性越弱,故D正确.
故选BD.
点评:本题考查氧化还原反应,侧重于学生的分析能力和基本概念的理解和运用的考查,为高频考点,注意从元素化合价的角度解答该题,难度不大,注意常见物质的性质以及相关基础知识的积累.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
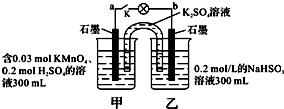

| A、当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1 |
| B、电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a |
| C、电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 |
| D、乙池中的氧化产物为SO42- |
下列有关原电池的说法中正确的是( )
| A、电极一定要由两种不同的金属组成 |
| B、电子流出的一极是正极 |
| C、两极均发生氧化还原反应 |
| D、由化学能转化为电能的装置 |
如图是锌铜原电池的示意图.下列关于锌铜原电池说法正确的是( )


| A、锌作正极 |
| B、溶液中SO42-向铜电极方向移动 |
| C、电子由锌片通过导线流向铜 |
| D、负极发生的反应是:2H++2e-=H2↑ |
下列既属于氧化还原反应,又属于吸热反应的是( )
| A、铝片和稀盐酸反应 |
| B、高温煅烧石灰石 |
| C、灼热的碳与二氧化碳的反应 |
| D、甲烷在氧气中的燃烧 |
某研究小组用新颖的NaBH4/H2O2燃料电池模拟电化学降解NO3-,下列说法不正确的是( )


| A、图1电池放电过程中,Na+从负极区向正极区迁移 |
| B、图1电池负极区的电极反应为:BH4--8e-+8OH-═BO2-+6H2O |
| C、图2中若电解过程中转移了a mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为6.2a g |
| D、图2阴极反应式为:2NO3-+6H2O+10e-═N2↑+12OH- |
已知R有多种化合价,其最高正价为+7价.在一定条件下,RO
与R-可发生反应:RO
+5R-+6H+=3R2+3H2O,下列关于R元素的叙述中,正确的是( )
- 3 |
- 3 |
| A、元素R位于周期表中第VA族 | ||
B、RO
| ||
| C、R-离子的最外层电子数为8 | ||
D、若1molRO
|
 卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近.试回答下列问题:
卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近.试回答下列问题: