题目内容
5.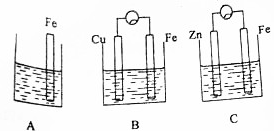 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.(1)图B、图C是一个将化学能转化为电能的装置,人们把它叫做原电池.
(2)B中Fe极电极反应式为Fe-2e-=Fe2+.
(3)C中被腐蚀的金属是Zn,总反应方程式为Zn+H2SO4=ZnSO4+H2↑.
(4)A、B、C中被腐蚀的速率,由大到小的顺序是B>A>C.
分析 (1)两个活泼性不同的金属电极在电解质溶液中形成原电池反应,原电池反应是化学能转化为电能的装置;
(2)B中Fe极做原电池负极,失去电子发生氧化反应;
(3)装置C为原电池反应,锌做负极被氧化,反应为锌和稀硫酸反应生成硫酸锌和氢气;
(4)A中铁和稀硫酸直接发生反应生成氢气,装置B中铁做原电池负极,腐蚀速率增大,装置C中铁做原电池正极被保护.
解答 解:(1)图B装置形成的是原电池反应,Fe做负极失去电子发生氧化反应,溶液中氢离子在铜电极得到电子发生还原反应生成氢气,装置C中形成的也是原电池反应,锌做负极失电子风扇氧化反应,溶液中氢离子在Fe电极得到电子发生还原反应生成氢气,发生的是原电池反应,都是化学能转化为电能的装置,称为原电池,
故答案为:化学;电;原电池;
(2)B装置中Fe做原电池负极,失去电子发生氧化反应生成亚铁离子,电极反应为:Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
(3)C中被腐蚀的金属是Zn,总反应化学方程式为:Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+H2SO4=ZnSO4+H2↑;
(4)A中铁和稀硫酸直接发生反应生成氢气,发生的是化学腐蚀,装置B中铁做原电池负极,腐蚀的是电化腐蚀,腐蚀速率增大,装置C中铁做原电池正极被保护,A、B、C中被腐蚀的速率,由大到小的顺序是:B>A>C,
故答案为:B>A>C.
点评 本题考查金属的电化学腐蚀与防护,题目难度不大,注意金属的电化学腐蚀与化学腐蚀的区别,以及比较金属腐蚀快慢的方法.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
15.某研究性学习小组查阅资料收集到如下信息:铁盐能蚀刻银而用来制作液晶显示器的银线路板.他们对蚀刻银的过程进行了探究.
【实验1】制备银镜:
(1)ⅰ.配制银氨溶液,需要的试剂是AgNO3溶液、稀氨水.并取等量银氨溶液于多支试管中.
ⅱ.向银氨溶液中加入等量的葡萄糖溶液,水浴加热.产生银镜,洗净,备用.
【实验2】溶解银镜:分别向两支试管中加入5mL Fe(NO3)3、Fe2(SO4)3溶液.
(2)选用Fe2(SO4)3溶液的浓度为0.05mol/L,目的是保证c(Fe3+)相等.
(3)从a、b中均检出了Fe2+,说明Fe3+具有氧化性.a中Fe3+氧化Ag的离子方程式
是Fe3++Ag═Fe2++Ag+.
(4)确认b中沉淀为Ag2SO4(微溶),检验Ag2SO4固体中SO42-的方法是取少量Ag2SO4固体于试管中,加入适量蒸馏水,振荡、静置,取上层清液,滴加Ba(NO3)2溶液,出现白色沉淀.
(5)推测在a中的酸性条件下NO3-氧化了银,证据是a中溶液黄色略变浅,b中溶液黄色明显变浅.通过如下实验验证了推测是合理的:
ⅰ.测pH:测定实验a中所用Fe(NO3)3溶液的pH=2;
ⅱ.配制溶液:配制pH=2,c(NO3-)=0.3mol/L的溶液.取5mL此溶液加入有银镜的试管,现象是银镜消失,溶液颜色无明显变化.
请将步骤ⅱ补充完整.
(6)分析a中白色沉淀的成分,提出假设.
假设1:Fe(OH)2; 假设2:AgNO2; 假设3:…
①设计实验方案验证假设1:取少量沉淀置于空气中,未变色.假设1不成立.
②设计实验方案验证假设2(已知:亚硝酸盐能与酸化的KI溶液反应).
【实验结论与讨论】铁盐能蚀刻银;NO3-能提高铁盐的蚀刻能力.推测硝酸铁溶液如果保持足够的酸性,可以避免产生沉淀.
【实验1】制备银镜:
(1)ⅰ.配制银氨溶液,需要的试剂是AgNO3溶液、稀氨水.并取等量银氨溶液于多支试管中.
ⅱ.向银氨溶液中加入等量的葡萄糖溶液,水浴加热.产生银镜,洗净,备用.
【实验2】溶解银镜:分别向两支试管中加入5mL Fe(NO3)3、Fe2(SO4)3溶液.
| 编号 | a | b |
| 试剂 | 0.1mol/L Fe(NO3)3 | 0.05mol/L Fe2(SO4)3 |
| 现象 | 银镜消失较快; 溶液黄色略变浅; 产生少许白色沉淀 | 银镜消失较慢; 溶液黄色明显变浅; 产生较多白色沉淀 |
(3)从a、b中均检出了Fe2+,说明Fe3+具有氧化性.a中Fe3+氧化Ag的离子方程式
是Fe3++Ag═Fe2++Ag+.
(4)确认b中沉淀为Ag2SO4(微溶),检验Ag2SO4固体中SO42-的方法是取少量Ag2SO4固体于试管中,加入适量蒸馏水,振荡、静置,取上层清液,滴加Ba(NO3)2溶液,出现白色沉淀.
(5)推测在a中的酸性条件下NO3-氧化了银,证据是a中溶液黄色略变浅,b中溶液黄色明显变浅.通过如下实验验证了推测是合理的:
ⅰ.测pH:测定实验a中所用Fe(NO3)3溶液的pH=2;
ⅱ.配制溶液:配制pH=2,c(NO3-)=0.3mol/L的溶液.取5mL此溶液加入有银镜的试管,现象是银镜消失,溶液颜色无明显变化.
请将步骤ⅱ补充完整.
(6)分析a中白色沉淀的成分,提出假设.
假设1:Fe(OH)2; 假设2:AgNO2; 假设3:…
①设计实验方案验证假设1:取少量沉淀置于空气中,未变色.假设1不成立.
②设计实验方案验证假设2(已知:亚硝酸盐能与酸化的KI溶液反应).
| 实验方案 | 预期现象和结论 |
13.下列操作实验操作、现象、解释或结论都正确的是( )
| 操作 | 现象 | 解释或结论 | |
| A | 充分浸透了 Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3可用作木材防火剂 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中有Na+、无K+ |
| C | 分别向含有酚酞的烧碱溶液中通入氯气、二氧化硫 | 溶液颜色都变淺 | 说明氯气和二氧化硫都有 漂白性 |
| D | 向某加碘食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加 KIO3 |
| A. | A | B. | B | C. | C | D. | D |
20.可用来鉴别淀粉溶液、苯、乙酸的试剂是( )
| A. | 碘水 | B. | 氯化钠溶液 | C. | 氢氧化钠溶液 | D. | 溴水 |
5.已知2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,下列说法中不正确的是( )
| A. | 相同条件下,H2O电解产物H2和O2的物质的量之比为2:1 | |
| B. | 相同条件下,H2O电解产物H2和O2的质量之比为2:1 | |
| C. | 相同条件下,1molH2与1molO2的体积相同 | |
| D. | 相同条件下,1molH2与1molO2的质量不相同 |
12.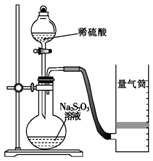 下面是某同学测定化学反应速率并探究其影响因素的实验.
下面是某同学测定化学反应速率并探究其影响因素的实验.
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)除如图所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法:测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化等(写一种).
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如表.(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
(4)该实验进行的目的是探究反应物浓度(Na2S2O3)对化学反应速率的影响,淀粉溶液的作用是作为显色剂,检验I2的存在,表中Vx=4.0 mL,通过比较t1、t2、t3大小,试推测该实验结论:其他条件不变,反应物浓度越大,化学反应速率越大.
 下面是某同学测定化学反应速率并探究其影响因素的实验.
下面是某同学测定化学反应速率并探究其影响因素的实验.Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)除如图所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法:测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化等(写一种).
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如表.(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |