题目内容
5.已知可逆反应:N2(g)+3H2(g)?2NH3(g),这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下列关于此反应的说法中错误的是( )| A. | 升高反应体系的温度,可使反应速率变大 | |
| B. | 该反应中N2不可能100%转化为NH3 | |
| C. | 该反应达到平衡状态时,N2、H2和NH3三者的浓度一定相等 | |
| D. | 为了提高H2的转化率,可适当提高N2的浓度 |
分析 A、根据影响化学反应速率的因素知识来回答,升高温度,增大压强,增加反应物浓度,加入催化剂均能使反应速率增大;
B、反应是可逆反应,反应物不能完全被转化;
C、该反应达到平衡状态时,各组分的浓度不随时间的变化而变化;
D、为了提高H2的转化率,可以采用使得化学平衡正向移动的措施.
解答 解:A、根据影响化学反应速率的因素知道:升高反应体系的温度,可使反应速率变大,故A正确;
B、反应是可逆反应,该反应中N2不可能100%转化为NH3,故B正确;
C、该反应达到平衡状态时,N2、H2和NH3三者的浓度不随时间的变化而变化,但是三者的浓度不一定相等,故C错误;
D、提高N2的浓度可以促使化学平衡正向移动,提高H2的转化率,故D正确.
故选C.
点评 本题考查学生影响化学反应速率的因素以及化学平衡移动的影响因素知识,注意知识的迁移应用是关键,难度中等.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
15.下列现象中,不能用“相似相溶”原理解释的是( )
| A. | 酒精与水以任意比互溶 | B. | 用纯碱洗涤油脂 | ||
| C. | 氨易溶于水 | D. | 用苯将溴水中的溴萃取出来 |
16.下列结构示意图中,表示的是阴离子且电荷最多的是( )
| A. | 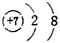 | B. | 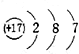 | C. | 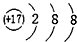 | D. | 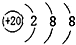 |
20.A和B两元素能形成AB2型离子化合物,则A和B的原子序数可能是( )
| A. | 6和8 | B. | 11和8 | C. | 20和8 | D. | 20和17 |
10.一定温度下的可逆反应:A(s)+2B(g)?2C(g)+D(g)△H<0.现将1mol A和2molB加入甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )
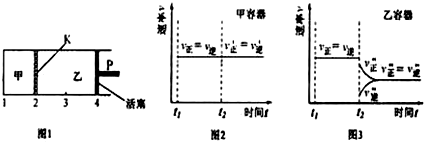

| A. | 保持温度和活塞位置不变,在甲中再加入1molA和2molB,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
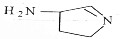 ,则分子中σ键与π键之比为14:1.
,则分子中σ键与π键之比为14:1.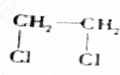 +2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl;
+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl;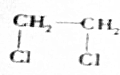 +2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaCl+2H2O;
+2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaCl+2H2O;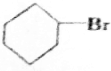 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$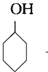 +NaBr;
+NaBr;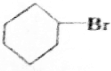 +NaOH$→_{△}^{C_{2}H_{5}OH}$
+NaOH$→_{△}^{C_{2}H_{5}OH}$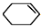 +H2O+NaBr.
+H2O+NaBr.

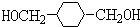 .
.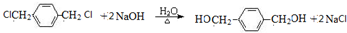 .
. .
.