题目内容
13.请按要求写出下列反应方程式:(1)请写出下列溶液水解(或双水解)的离子反应方程式:
①次氯酸钠溶液:ClO-+H2O
 HClO+OH-
HClO+OH-②泡沫灭火器工作原理:Al3++3HCO3-═Al(OH)3↓+3CO2↑
③氯化铁溶液与偏铝酸钾溶液混合:Fe3++3AlO2-+6H2O=Fe(OH)3↓+3Al(OH)3↓
(2)请写出酸性条件下氢氧燃料电池的电极反应方程式:
负极:H2-2e-═2H+
正极:O2+4e-+4H+═2H2O.
分析 (1)①次氯酸根离子水解生成HClO和氢氧根离子;
②铝离子与碳酸氢根离子相互促进水解生成沉淀和气体;
③相互促进水解生成氢氧化铁、氢氧化铝沉淀;
(2)酸性条件下氢氧燃料电池中,负极上氢气失去电子生成氢离子,正极上氧气得到电子生成水.
解答 解:(1)①次氯酸根离子水解生成HClO和氢氧根离子,离子反应为ClO-+H2O HClO+OH-,故答案为:ClO-+H2O
HClO+OH-,故答案为:ClO-+H2O HClO+OH-;
HClO+OH-;
②铝离子与碳酸氢根离子相互促进水解生成沉淀和气体,离子反应为Al3++3HCO3-═Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-═Al(OH)3↓+3CO2↑;
③相互促进水解生成氢氧化铁、氢氧化铝沉淀,离子反应为Fe3++3AlO2-+6H2O=Fe(OH)3↓+3Al(OH)3↓,故答案为:Fe3++3AlO2-+6H2O=Fe(OH)3↓+3Al(OH)3↓;
(2)电解质溶液呈酸性,负极反应为H2-2e-═2H+,正极反应为O2+4e-+4H+═2H2O,故答案为:H2-2e-═2H+;O2+4e-+4H+═2H2O.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重水解反应及电极反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.探究:1-氯丙烷与NaOH乙醇溶液的反应
学习小组在进行1-氯丙烷与NaOH乙醇溶液的反应中,观察到有气体生成.
请你设计两种不同的方法分别检验该气体.在答题卡的方框中写出装置中所盛试剂的名称(试剂任选)和实验现象.
学习小组在进行1-氯丙烷与NaOH乙醇溶液的反应中,观察到有气体生成.
请你设计两种不同的方法分别检验该气体.在答题卡的方框中写出装置中所盛试剂的名称(试剂任选)和实验现象.
| 装置图 | 所盛试剂 | 实验现象 | |
| 1 | 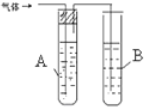 | A是 水 B是 酸性高锰酸钾溶液 | |
| 2 |  | C是 溴的四氯化碳溶液 |
8.取少量MgO、Al2O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到沉淀X和滤液Y.下列叙述正确的是( )
| A. | 上述四种氧化物中,只有SiO2是酸性氧化物,它不溶于任何酸 | |
| B. | 向沉淀X中逐滴加入硝酸,沉淀慢慢溶解 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2 |
18.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 8g18O2含有的中子数为5NA | |
| B. | 1molFeI2与足量Cl2氯气充分反应转移的电子数为2NA | |
| C. | 标准状况下22.4LNO与11.2LO2混合后的气体分子数约为NA | |
| D. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
5.下列反应中氧化剂和还原剂的物质的量之比为1:2的是( )
| A. | 铜和浓硝酸反应 | B. | 工业合成氨的反应 | ||
| C. | 工业制粗硅的反应 | D. | 铜和浓硫酸反应 |
2.2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述错误的是( )


| A. | 理论上外电路中每转移1mol电子,负极消耗的质量为7g | |
| B. | 可以将Li+快离子导体更换成阳离子交换膜,去掉聚合物电解质直接使用Li2SO4水溶液 | |
| C. | 电池放电反应为 Li1-xMn2O4+xLi═LiMn2O4 | |
| D. | 放电时,溶液中的Li+从b向a迁移 |
3.下列溶液中NO${\;}_{3}^{-}$的物质的量浓度最大的是( )
| A. | 50 mL 1 mol•L-1的KNO3溶液 | B. | 50 mL 1 mol•L-1的Fe(NO3)3 | ||
| C. | 1 L 0.5 mol•L-1的Mg(NO3)2溶液 | D. | 1 L 0.5 mol•L-1的Ba(NO3)2溶液 |
 丙烯酰胺是一种重要的有机合成的中间体.它的球棍模型如图所示:(图中“棍”代表单键或双键或三健,不同颜色球表示不同原子:C、H、O、N)
丙烯酰胺是一种重要的有机合成的中间体.它的球棍模型如图所示:(图中“棍”代表单键或双键或三健,不同颜色球表示不同原子:C、H、O、N) .
.