题目内容
15.在NH3、H2、N2、O2、SO2、NO2、Cl2等七种气体中:(1)比空气密度小的气体是NH3、H2、N2;
(2)有刺激性气味的气体是NH3、SO2、NO2、Cl2;
(3)有颜色的气体是NO2、Cl2;
(4)水溶液呈碱性的气体是NH3;
(5)常用作氧化剂的气体是O2、Cl2;
(6)常用作还原剂的气体是H2、SO2;
(7)能用排水法收集的气体是H2、N2、O2;
(8)能与水反应,且在反应中既做氧化剂又做还原剂的气体是NO2、Cl2.
分析 根据气体的密度、颜色、气味、溶解性等性质分析,反应中作氧化剂,则所含的元素的化合价降低,反应中作还原剂,则所含的元素的化合价升高,据此分析.
解答 解:NH3是一种无色有刺激性气味的气体,易溶于水,能与水反应生成一水合氨,一水合氨为弱碱,密度比空气的小;
H2是一种无色无味的气体,难溶于水,密度比空气的小,具有较强的还原性,常用作还原剂;
N2是一种无色无味的气体,难溶于水,密度比空气的略小;
O2是一种无色无味的气体,难溶于水,密度比空气的大,氧气具有较强的氧化性,可以作氧化剂;
SO2是一种无色有刺激性气味的气体,易溶于水,能与水反应生成亚硫酸,亚硫酸为中强酸,SO2的密度比空气的大,SO2具有较强的还原性,常用作还原剂;
NO2是一种红棕色有刺激性气味的气体,易溶于水,密度比空气的大,能与水反应生成硝酸,硝酸为强酸,反应中N元素的化合价即升高又降低,NO2既做氧化剂又做还原剂;
Cl2是一种黄绿色有刺激性气味的气体,密度比空气的大,能溶于水,能与水反应生HCl和HClO,反应中Cl元素的化合价即升高又降低,Cl2既做氧化剂又做还原剂,氯气具有强氧化性,可作氧化剂;
故答案为:(1)NH3、H2、N2;(2)NH3、SO2、NO2、Cl2;(3)NO2、Cl2;(4)NH3;(5)O2、Cl2;(6)H2、SO2;(7)H2、N2、O2(8)NO2、Cl2.
点评 本题考查NH3、H2、N2、O2、SO2、NO2、Cl2等七种气体的物理和化学性质,题目难度不大,注意把握气体与水反应时发生的反应,注意相关基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列各组物质的无色溶液,不用其他试剂即可鉴别的是( )
①NaOH、AlCl3 ②NaHCO3、H2SO4 ③NaAlO2、NaHSO4④Na2CO3、HCl ⑤Na2CO3、NaHCO3、Ca(OH)2.
①NaOH、AlCl3 ②NaHCO3、H2SO4 ③NaAlO2、NaHSO4④Na2CO3、HCl ⑤Na2CO3、NaHCO3、Ca(OH)2.
| A. | ①③④ | B. | ①②③ | C. | ①③⑤ | D. | ①②⑤ |
6.下列操作或装置中,不能达到实验目的是( )
| A. | 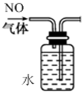 排水法收集NO | |
| B. | 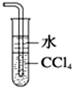 吸收尾气中少量NH3或HCl,并防止倒吸 | |
| C. |  制取并收集少量NH3 | |
| D. | 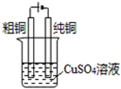 电解精炼铜 |
20.下列溶液中通入过量的CO2气体后,溶液变浑浊的是( )
| A. | 苯酚钠 | B. | 酯酸钠 | C. | 氢氧化钠 | D. | 石灰水 |
7.下列各组元素中,按微粒半径递增顺序排列的是( )
| A. | Li、Na、K | B. | Ba2+、Ca2+、Mg2+ | C. | K+、Ca2+、Cl- | D. | N、O、F |
4.托盘天平两盘各放置一个盛有100g 9.8%的稀硫酸的烧杯,并使天平保持平衡.若两烧杯中分别加入下列各组物质,反应结束后,天平仍保持平衡的是( )
| A. | 2.4gMg和6.5g Zn | B. | Mg和Zn各2.5g | C. | Mg和Al各2.5g | D. | 2.3gNa和2.4gMg |
5.化学式为C9H12的芳香烃的一卤代物数目和化学式为C7H8O且遇FeCl3溶液显紫色的芳香族化合物数目分别为( )
| A. | 7种和2种 | B. | 8种和3种 | C. | 42种和3种 | D. | 56种和3种 |
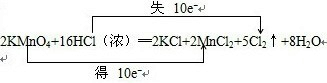 ;
;