题目内容
5.下列溶液导电性最强的是( )| A. | 1 L 0.1 mol•L-1醋酸 | B. | 0.1 L 1 mol•L-1H2SO4溶液 | ||
| C. | 0.5 L 0.1mol•L-1盐酸 | D. | 2 L 0.1mol•L-1 H2SO3溶液 |
分析 电解质溶液导电性能力离子浓度成正比,物质的水溶液导电性最强,说明溶液中离子浓度最大,据此分析解答.
解答 解:电解质溶液导电性能力离子浓度成正比,物质的水溶液导电性最强,说明溶液中离子浓度最大,醋酸和H2SO3是弱电解质部分电离,H2SO4、HCL都是强电解质,在水溶液中完全电离,但H2SO4溶液离子浓度最大为2mol/L,所以导电能力最大的是硫酸溶液,故选B.
点评 本题考查电解质溶液导电性强弱判断,为高频考点,明确溶液导电性强弱影响因素是解本题关键,电解质溶液导电性强弱与离子浓度成正比,与电解质强弱无关,题目难度不大.

练习册系列答案
相关题目
2.相同状况下,4体积NO2与1.5体积O2混合通过适量水,收集到的气体体积为( )
| A. | 0.5体积 | B. | 2体积 | C. | 3体积 | D. | 4.5体积 |
13.下列事实能说明金属甲比金属乙的活动性强的是( )
| A. | 在发生化学反应时,甲原子失电子数比乙原子多 | |
| B. | 甲的阳离子的氧化性比乙离子强 | |
| C. | 甲的氢氧化物的碱性小于乙的氢氧化物的碱性 | |
| D. | 在甲、乙、硫酸组成的原电池中,甲为负极 |
20.下列实验观察记录错误的是( )
| A. | 硫酸铝溶液中加入过量氨水,振荡,可观察到生成白色沉淀 | |
| B. | 钠在空气中加热,钠块先熔成光亮的银白色小球后燃烧,发出黄色火焰 | |
| C. | 在盛Na2O2固体的试管中先后滴入水和酚酞溶液,溶液最终呈红色 | |
| D. | 新制氯水中滴加紫色石蕊溶液先变红后褪色. |
10.用足量的CO还原32.0g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60g沉淀,则该氧化物是( )
| A. | FeO | B. | Fe2O3 | C. | CuO | D. | Fe3O4 |
17.部分弱酸的电离平衡常数如下表:
下列选项错误的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25°C)) | Ki=1.77×10-4 | Ki=4.9×10-18 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | CN-+H2O+CO2→HCN+HCO3- | |
| B. | 2HCOOH+CO32-→2HCOO-+H2O+CO2↑ | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| D. | 等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 |
14.设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是( )
| A. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA | |
| B. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| C. | 0.1mol/L的氢氧化钠溶液中含钠离子数为0.1NA个 | |
| D. | 0.30mol Fe粉与足量水蒸气反应生成的H2分子数为0.40NA |
15. 二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
①2H2(g)+O2(g)═2H2O(l)△H=-283.0 kJ/mol;
②2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-726.0 kJ/mol.
(1)完成二氧化碳与氢气合成甲醇液体的热化学方程式:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-61.5kJ/mol
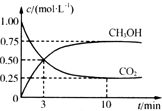
(2)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ/mol测得CO2(g)和CH3OH(l)的浓度随时间的变化如图所示,平衡时CH3OH的体积分数为30%.
(3)已知反应2CH3OH?CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正>(填“>”、“<“或“=”)v逆;
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(4)甲醇-空气燃料电池是利用稀土金属氧化物作为固体电解质,这种稀土金属氧化物在高温下能传导O2-.
①负极发生的反应是CH3OH-6e-+3O2-=CO2+2H2O;
②在稀土金属氧化物的固体电解质中,O2-的移动方向是A.(填字母)
A.从正极移向负极 B.从负极移向正极 C.从阳极移向阴极 D.从阴极移向阳极.
 二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:①2H2(g)+O2(g)═2H2O(l)△H=-283.0 kJ/mol;
②2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-726.0 kJ/mol.
(1)完成二氧化碳与氢气合成甲醇液体的热化学方程式:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-61.5kJ/mol
(2)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ/mol测得CO2(g)和CH3OH(l)的浓度随时间的变化如图所示,平衡时CH3OH的体积分数为30%.
(3)已知反应2CH3OH?CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(4)甲醇-空气燃料电池是利用稀土金属氧化物作为固体电解质,这种稀土金属氧化物在高温下能传导O2-.
①负极发生的反应是CH3OH-6e-+3O2-=CO2+2H2O;
②在稀土金属氧化物的固体电解质中,O2-的移动方向是A.(填字母)
A.从正极移向负极 B.从负极移向正极 C.从阳极移向阴极 D.从阴极移向阳极.