题目内容
10.用足量的CO还原32.0g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60g沉淀,则该氧化物是( )| A. | FeO | B. | Fe2O3 | C. | CuO | D. | Fe3O4 |
分析 先根据生成的气体通入足量澄清石灰水中得到60g沉淀求出二氧化碳的物质的量,再计算出金属氧化物中氧元素的质量,然后利用金属氧化物的质量来计算金属元素与氧元素的质量比,则选项中金属元素与氧元素的质量比符合的即为正确答案.
解答 解:由题意知60g沉淀为碳酸钙的质量,
则碳酸钙的物质的量为$\frac{60g}{100g/mol}$=0.6mol,
由CO还原32.0g某种氧化物,将生成的气体通入足量澄清石灰水中得到沉淀,
设金属氧化物中氧元素的质量为x,
根据碳元素守恒可知CO~O~CO2~CaCO3,
16 1
x 0.6mol
x=$\frac{16×0.6mol}{1}$,解得x=9.6g,
则32.0g氧化物中金属元素与氧元素的质量比为$\frac{32.0g-9.6g}{9.6g}$=7:3,
A、FeO中铁与氧元素的质量比为56:16=7:2,与计算结果不符,故A错误;
B、Fe2O3中铁与氧元素的质量比为56×2:16×3=7:3,与计算结果符合,故B正确;
C、CuO中铜与氧元素的质量比为64:16=4:1,与计算结果不符,故C错误;
D、Fe3O4中铁与氧元素的质量比为56×3:16×4=21:4,与计算结果不符,故D错误;
故选B.
点评 本题考查学生利用化学反应及物质的化学式的计算,明确反应中元素的守恒来分析金属氧化物中氧元素的质量是解答的关键,并应熟悉元素的质量比计算方法来解答即可.

练习册系列答案
相关题目
7.下列离子在溶液中能大量共存的是( )
| A. | Na+、CO32-、SO42-、H+ | B. | K+、AlO2-、H+、Cl- | ||
| C. | Fe3+、K+、OH-、NO3- | D. | Al3+、H+、NO3-、SO42- |
1.下列说法正确的是( )
| A. | 在101kPa时,1molS完全燃烧生成SO3时所放出的热量,是S的燃烧热 | |
| B. | 吸热反应必须加热才能反应,放热反应不需要加热 | |
| C. | 在101kPa时,1mol S和2mol S的燃烧热相同 | |
| D. | 在稀溶液中,H2SO4和Ba(OH)2完全中和产生1mol水时放出的热量为57.3kJ |
18.丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,沸点约55℃,分离水和丙酮时最合理的方法是( )
| A. | 蒸馏 | B. | 分液 | C. | 过滤 | D. | 蒸发 |
5.下列溶液导电性最强的是( )
| A. | 1 L 0.1 mol•L-1醋酸 | B. | 0.1 L 1 mol•L-1H2SO4溶液 | ||
| C. | 0.5 L 0.1mol•L-1盐酸 | D. | 2 L 0.1mol•L-1 H2SO3溶液 |
15.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L -1 NaHC2O4溶液与0.1 mol•L -1KOH溶液等体积混合,所得溶液中:c(Na+)>c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-) | |
| B. | 20mL 0.1 mol•L -1NH4Cl溶液与10mL 0.1 mol•L -1NaOH溶液混合后溶液呈碱性,所得溶液中:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常温下,pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中:c(Na+)+c(OH-)>c(H+)+c(F-) | |
| D. | 0.1 mol•L -1NH3•H2O溶液与0.1 mol•L -1HNO3溶液等体积混合,所得溶液中:c(H+)>c(OH-)+c(NH3•H2O) |
19.(1)为达下表所列实验目的,请选择合适的实验方法,将其标号填在相应的空格中.
A、加热至恒重 B、用氢氧化钠溶液溶解后过滤
C.溶解、过滤、结晶 D.滴加KSCN溶液观察是否溶液是否变红
(2)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液.为鉴别两溶液,进行以下实验:取甲溶液于试管,向其中缓慢滴入乙溶液,并边滴加边振荡,观察到开始无明显现象,后来有大量气体生成.甲是Na2CO3溶液;
实验过程中所发生反应的离子方程式为:CO32-+H+=HCO3-、HCO3-+H+=CO2+H2O;
(3)将CO2和SO2气体分别通入酸性高锰酸钾,使之褪色的是SO2气体,请写出该反应的离子方程式:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
| 实验目的 | 标号 |
| 检验氯化亚铁是否变质 | |
| 除去食盐中少量细砂 | |
| 除去碳酸钠固体中少量碳酸氢钠 | |
| 除去镁粉中混有的少量铝粉 |
C.溶解、过滤、结晶 D.滴加KSCN溶液观察是否溶液是否变红
(2)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液.为鉴别两溶液,进行以下实验:取甲溶液于试管,向其中缓慢滴入乙溶液,并边滴加边振荡,观察到开始无明显现象,后来有大量气体生成.甲是Na2CO3溶液;
实验过程中所发生反应的离子方程式为:CO32-+H+=HCO3-、HCO3-+H+=CO2+H2O;
(3)将CO2和SO2气体分别通入酸性高锰酸钾,使之褪色的是SO2气体,请写出该反应的离子方程式:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
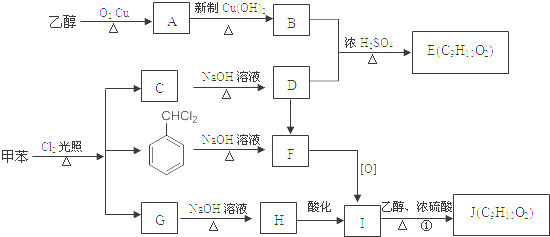

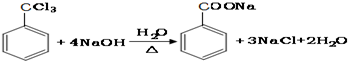 .
. ;②
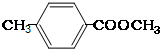
;②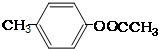 ;③
;③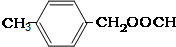 或
或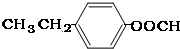 .
.