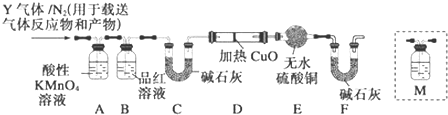
题目内容
11.写出下列烷烃的分子式(1)烷烃A在同温同压下蒸气的密度是氢气的36倍C5H12.
(2)烷烃B的分子中含有200个氢原子C99H200.
(3)1L烷烃D的蒸气完全燃烧时,生成同温同压下15L的水蒸气C14H30.
(4)0.01mol烷烃E完全燃烧时,消耗标准状况下的氧气2.464LC7H16.
分析 (1)相对密度之比等于相对分子质量之比,计算烷烃A的相对分子质量,结合烷烃组成通式CnH2n+2确定分子式;
(2)根据烷烃组成通式CnH2n+2确定分子式;
(3)根据H原子守恒计算分子中H原子数目,结合烷烃组成通式确定;
(4)烷烃燃烧通式为:CnH2n+2+$\frac{3n+1}{2}$O2$\frac{\underline{\;点燃\;}}{\;}$nCO2+(n+1)H2O.
解答 解:(1)烷烃A的相对分子质量为36×2=72,烷烃组成通式为CnH2n+2,则14n+2=72,解得n=5,故A的分子式为C5H12,
故答案为:C5H12;
(2)烷烃组成通式为CnH2n+2,烷烃B的分子中含有200个氢原子,则2n+2=200,解得n=99,故B的分子式为C99H200,
故答案为:C99H200;
(3)1L烷烃D的蒸气完全燃烧时,生成同温同压下15L的水蒸气,根据H原子守恒,分子中H原子数目为$\frac{15L×2}{1L}$=30,则烷烃组成通式为CnH2n+2,则2n+2=30,解得n=14,故D的分子式为C14H30,
故答案为:C14H30;
(4)烷烃燃烧通式为:CnH2n+2+$\frac{3n+1}{2}$O2$\frac{\underline{\;点燃\;}}{\;}$nCO2+(n+1)H2O,0.01mol烷烃E完全燃烧时,消耗标准状况下的氧气2.464L,则0.01mol×$\frac{3n+1}{2}$×22.4L/mol=2.464L,解得n=7,故E的分子式为:,
故答案为:C7H16.
点评 本题考查有机物分子式确定,注意对烷烃组成通式的运用,有利于基础知识的巩固.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
1.下列实验操作能达到目的是( )
| A. | 锅炉水垢用饱和纯碱溶液浸泡,即可除去 | |
| B. | 向淀粉水解后的溶液中滴加碘水,即可检验淀粉是否水解完全 | |
| C. | 向C2H5X消去反应后的溶液中滴加硝酸银溶液,即可检验卤原子X的种类 | |
| D. | 将25 g CuSO4•5H2O溶于100 mL水中,可配得100 mL1.0 mol/L CuSO4溶液 |
8.判断下列反应的熵值增加的是( )
| A. | 2H2(g)+O2(g)═2H2O(l) | B. | H2(g)+Cl2(g)═2HCl(g) | ||
| C. | (NH4 )2 CO3(s)═NH4HCO3(s)+NH3(g) | D. | Cu(s)+Cl2(g)═CuCl2(s) |
 .
.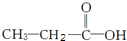 和
和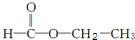 两种,为对其结构进行物理方法鉴定,常用红外光谱和核磁共振氢谱法.
两种,为对其结构进行物理方法鉴定,常用红外光谱和核磁共振氢谱法.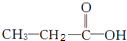 ,则红外光谱中应该有5个吸收峰;核磁共振氢谱中应有4个吸收峰.
,则红外光谱中应该有5个吸收峰;核磁共振氢谱中应有4个吸收峰. ,则红外光谱中应该有4个吸收峰;核磁共振氢谱中应有3个吸收峰.
,则红外光谱中应该有4个吸收峰;核磁共振氢谱中应有3个吸收峰. 如图是A分子的球棍模型和B分子的比例模型,回答下列问
如图是A分子的球棍模型和B分子的比例模型,回答下列问