题目内容
10.某学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂.用盐酸滴定待测液NaOH,滴定终点时的颜色变化是当滴加最后一滴标准液时,溶液由红色变为无色,且30s不复色;若滴定前平视读数,滴定终点时俯视读数,则会使所测NaOH溶液的浓度值偏低(填“无影响”、“偏高”或“偏低”).
分析 根据滴定终点,锥形瓶中的溶液颜色发生变化,且30s内不恢复;根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:用盐酸滴定氢氧化钠溶液以酚酞作指示剂,终点现象是当滴加最后一滴标准液时,溶液由红色变为无色,且30s不复色;
若滴定前平视读数,滴定终点时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,可知c(标准)偏小;
故答案为:当滴加最后一滴标准液时,溶液由红色变为无色,且30s不复色;偏低.
点评 本题主要考查了中和滴定操作以及注意事项,难度不大,应注意相关知识的积累.

练习册系列答案
相关题目
13.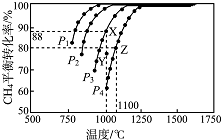 现向一密闭容器中充入物质的量浓度均为0.10mol/L的CH4和CO2,一定条件下发生反应:CH4(g)+CO2( g)═2CO(g)+2H2 (g)△H,测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
现向一密闭容器中充入物质的量浓度均为0.10mol/L的CH4和CO2,一定条件下发生反应:CH4(g)+CO2( g)═2CO(g)+2H2 (g)△H,测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
 现向一密闭容器中充入物质的量浓度均为0.10mol/L的CH4和CO2,一定条件下发生反应:CH4(g)+CO2( g)═2CO(g)+2H2 (g)△H,测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
现向一密闭容器中充入物质的量浓度均为0.10mol/L的CH4和CO2,一定条件下发生反应:CH4(g)+CO2( g)═2CO(g)+2H2 (g)△H,测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )| A. | △H>0 | |
| B. | P4>P3>P2>Pl | |
| C. | 1000℃,P3条件下,在Y点:v(正)<v(逆) | |
| D. | 1100℃,P4条件下,该反应的平衡常数K=l.64 (mol/L)2 |
5.(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,混合溶液中由水电离出的c(H+)>0.2mol/LHCl溶液中由水电离出的c(H+)(填“>”、“<”、或“=”).
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度<MCl的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将0.1mol/L的HR溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH>7.(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
①待测NaOH溶液的物质的量浓度为0.1149mol/L.(保留四位有效数字)
②下列情况可能引起测定结果偏高的是AB.
A.酸式滴定管未用标准盐酸溶液润洗 B.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
C.锥形瓶未用待测液润洗 D.酸式滴定管滴定前平视读数,滴定后俯视读数
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
滴定时,你认为该滴定适宜选用的指示剂是下列中的D.
A.KBr B.KI C.K2S D.K2CrO4.
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度<MCl的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将0.1mol/L的HR溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH>7.(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 | 0.1032mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
②下列情况可能引起测定结果偏高的是AB.
A.酸式滴定管未用标准盐酸溶液润洗 B.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
C.锥形瓶未用待测液润洗 D.酸式滴定管滴定前平视读数,滴定后俯视读数
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
A.KBr B.KI C.K2S D.K2CrO4.
15.U、V、W、Y是原子序数依次增大的短周期主族元素,U、Y在周期表中的相对位置如表;U元素与氧元素能形成两种无色气体;W是地壳中含量最多的金属元素.
根据题意完成下列填空:
(1)元素W的原子核外共有5种不同能级的电子.
(2)下列反应在恒容密闭容器中进行:2YO2(g)+O2(g)$?_{催化剂}^{450℃}$ 2YO3(g)+190kJ
①该反应 450℃时的平衡常数大于500℃时的平衡常数(填“大于”、“小于”或“等于”).
②下列描述中能说明上述反应已达平衡的是bd
a.ν(O2)正=2ν(YO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
③在一个固定容积为5L的密闭容器中充入0.20 mol YO2和0.10molO2,半分钟后达到平衡,测得容器中含YO30.18mol,则ν(O2)=0.36mol•L-1•min-1:若继续通入0.20molYO2和0,.10molO2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36mol<n(YO3)<0.40mol.
(3)V的最简单气态氢化物甲的水溶液显碱性.
一定条件下,甲在恒容密闭容器中发生分解反应(正反应放向为吸热反应)并达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是bc.(选填序号).
(4)向含4mol V的最高价含氧酸的稀溶液中,逐渐加入Fe粉至过量.假设生成的气体只有一种,请在坐标系中画出n(Fe2+)随n(Fe)变化的示意图.
| U | ||
| Y |
(1)元素W的原子核外共有5种不同能级的电子.
(2)下列反应在恒容密闭容器中进行:2YO2(g)+O2(g)$?_{催化剂}^{450℃}$ 2YO3(g)+190kJ
①该反应 450℃时的平衡常数大于500℃时的平衡常数(填“大于”、“小于”或“等于”).
②下列描述中能说明上述反应已达平衡的是bd
a.ν(O2)正=2ν(YO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
③在一个固定容积为5L的密闭容器中充入0.20 mol YO2和0.10molO2,半分钟后达到平衡,测得容器中含YO30.18mol,则ν(O2)=0.36mol•L-1•min-1:若继续通入0.20molYO2和0,.10molO2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36mol<n(YO3)<0.40mol.
(3)V的最简单气态氢化物甲的水溶液显碱性.
一定条件下,甲在恒容密闭容器中发生分解反应(正反应放向为吸热反应)并达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是bc.(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |

19.下列表示物质变化的式子正确的是( )
| A. | 氯气通入水中Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫化钠加入水中S2-+2H2O═H2S+2OH- | |
| C. | 冰醋酸加入水中CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 铁与水蒸气反应2Fe+3H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2 |
20.25℃时,浓度均为1mol/L的AX、BX、AY、BY四种正盐溶液,AX溶液的pH=7且溶液 中c(X-)=1mol/L,BX溶液的pH=4,BY溶液的pH=6,下列说法正确的是( )
| A. | AY溶液的pH小于7 | |
| B. | AY溶液的pH小于BY溶液的pH | |
| C. | 稀释相同倍数,BX溶液的pH变化小于BY溶液 | |
| D. | 电离平衡常数K(BOH)小于K(HY) |
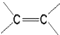 )中的π-键不能自由旋转,因此
)中的π-键不能自由旋转,因此 和
和 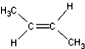 是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )
是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )